-
合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g) 2NH3(g) ∆H
2NH3(g) ∆H
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
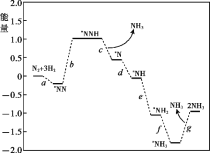
① NH3的电子式是_______。
② 写出步骤c的化学方程式_______。
③ 由图像可知合成氨反应的∆H______0(填“>”、“<”或“=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0 L的反应容器中投入5 mol N2、15 mol H2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
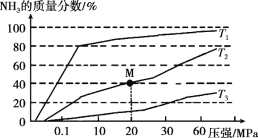
① 温度T1、T2、T3大小关系是_______。
② M点的平衡常数 K = _______(可用分数表示)。
(3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如下:
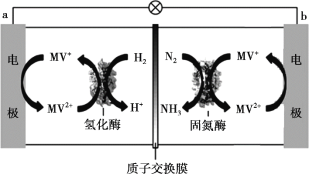
① 导线中电子移动方向是_______。
② 固氮酶区域发生反应的离子方程式是_______。
③ 相比传统工业合成氨,该方法的优点有_______。
-
氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
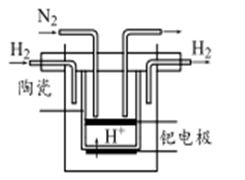
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。
(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I)  4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)  2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
-
氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。
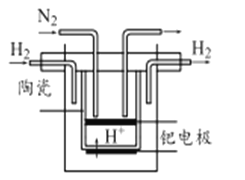
(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I)  4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)  2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
-
德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
一种利用天然气合成氨的简易流程如下:
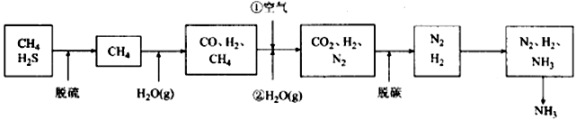
天然气先经脱硫,然后通过两次转化,再经过二氧化碳脱除等工序,得到氮氢混合气,进入氨合成塔,制得产品氨。
(1)根据化学平衡移动原理,为提高合成氨的生产效率,选择氨合成塔中适宜的生产条件是 。
(2)CH4与水蒸气制氢气的反应为CH4(g)+ H2O (g)  CO (g) +3H2(g),在2 L的密闭容器中,将物质的量各1 mol的CH4和H2O (g)混合反应,CH4的平衡转化率与温度、压强的关系如下图所示:
CO (g) +3H2(g),在2 L的密闭容器中,将物质的量各1 mol的CH4和H2O (g)混合反应,CH4的平衡转化率与温度、压强的关系如下图所示:
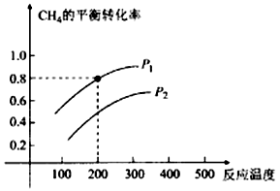
①该反应的△H 0(填﹥、﹤)。
②图中压强P1 P2(填﹥、﹤)。
③200℃时该反应的平衡常数K= (保留一位小数)。
(3)NH3经过催化氧化生成NO,以NO为原料通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O 3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式: ;阳极反应式: ;电解过程中需要补充一种物质才能使电解产物全部转化为NH4NO3,该物质是 。
3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式: ;阳极反应式: ;电解过程中需要补充一种物质才能使电解产物全部转化为NH4NO3,该物质是 。
-
合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)⇌2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。
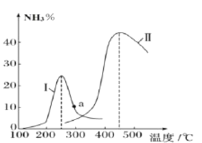
(2)氨气的分解反应2NH3⇌N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
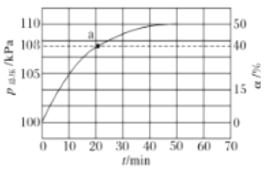
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正•p2(NH3)-K逆•p(N2)•p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的 =__。
=__。
(3)液氨中,2NH3(l)⇌NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的 =____。(已知25℃,Kb(NH3•H2O)=1.810-5;Ka1(H2SO3)=1.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3•H2O)=1.810-5;Ka1(H2SO3)=1.310-2,Ka2(H2SO3)=6.210-8)
-
过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)合成氨反应。
已知,氨的分解反应:2NH3(g)⇌ N2(g)+3H2 (g),活化能Ea=600kJ•mol-1,合成氨有关化学键的键能如下表:
| 化学键 | H—H | N≡N | N—H |
| E/kJ•mol-1 | 436 | 946 | 391 |
则合成氨反应: N2(g)+
N2(g)+ H2(g)⇌NH3(g)的活化能Ea=________。
H2(g)⇌NH3(g)的活化能Ea=________。
(2)已知2NO+O2=2NO2反应历程分两步
| 方程式 | 活化能 | 焓变 |
| 总反应 | 2NO(g)+O2(g)=2NO2(g) | 
| △H<0 |
| 第一步(快速平衡) | 2NO(g)⇌N2O2(g) | Ea1 | △H1 |
| 第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如: ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数 ________(用
________(用 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。
②用NO表示总反应的速率方程为 ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为 ,
, 与
与 是速率常数,则
是速率常数,则 ________。
________。
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是________。
A. B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
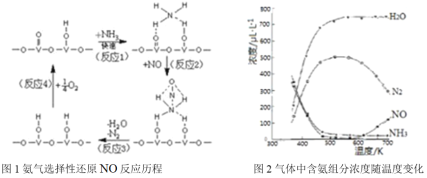
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式_______,该反应的含氮气体组分随温度变化如图2所示,当温度大于600K时,可能发生副反应的化学方程式_________。
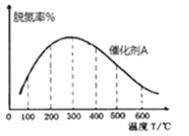
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线______________。
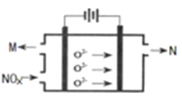
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为_________。
-
研究表明:在合成氨反应过程中,N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成了NH3(反应过程中各粒子均为气态):下列说法正确的是( )
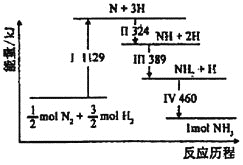
A.N2(g)+3H2(g)⇌2NH3(g) ΔH=+88kJ•mol-1
B.N2(g)+3H2(g)⇌2NH2(g)+2H(g) ΔH=-832kJ•mol-1
C.合成氨反应中正反应活化能小于逆反应活化能
D.Ⅰ,Ⅱ,Ⅲ,Ⅳ均为放热过程
-
2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
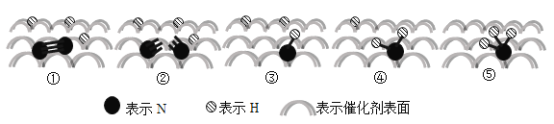
N2(g)+3H2(g) 2NH3(g) △H = −92 kJ/mol
2NH3(g) △H = −92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率
B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂
D.反应过程中存在−NH−、−NH2等中间产物
-
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH=-92.4 kJ/mol,该反应的能量变化如图所示。
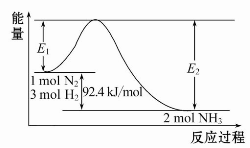
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入一定量H2
C.改变反应的催化剂
D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
ΔH=+1 530 kJ/mol
又知:H2O(l) H2O(g) ΔH=+44.0 kJ/mol
H2O(g) ΔH=+44.0 kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ∆H= —92.4kJ•mol‾1 一种工业合成氨的简易流程图如下:
2NH3(g) ∆H= —92.4kJ•mol‾1 一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,写出氨水的电离方程式 。吸收产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出吸收液再生反应的化学方程式 。
(2)步骤II中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) △H=+206.4 kJ·mol-1
CO(g)+3H2(g) △H=+206.4 kJ·mol-1
②CO(g)+ H2O(g)  CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)  CO2(g)+4H2(g) △H= kJ·mol-1。
CO2(g)+4H2(g) △H= kJ·mol-1。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是(填编号) 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O蒸气反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(4)下图1表示500℃、60.0MPa条件下,H2和N2为原料气的投料比与平衡时NH3体积分数的关系。根 据图中a点数据计算N2的平衡体积分数为 。
(5)依据温度对合成氨反应的影响,在下图2坐标系中,画出一定条件下的密闭容器内,从通入起始原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
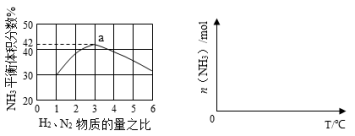
图1 图2
(6)简述本流程中提高合成氨原料总转化率的方法 。
2NH3(g) ∆H
















