-
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH=-92.4 kJ/mol,该反应的能量变化如图所示。
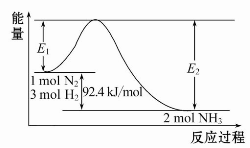
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入一定量H2
C.改变反应的催化剂
D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
ΔH=+1 530 kJ/mol
又知:H2O(l) H2O(g) ΔH=+44.0 kJ/mol
H2O(g) ΔH=+44.0 kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
-
I.科学家一直致力于“人工固氮”的新方法研究.
(l)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol
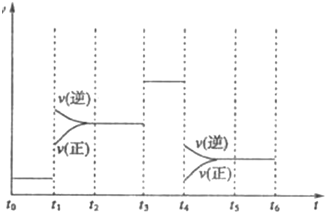
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为________;t1时刻改变的反应条件是________.
②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是________ (填序号).
a. b.
b. c.c(H+).c(OH-)d.
c.c(H+).c(OH-)d.
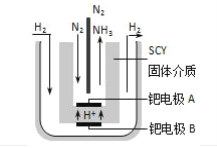
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式________.
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a________ 0,△S________ 0,(填“>”“<”或“=”).
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=________.
-
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止
-
科学家一直致力于“人工固氮”的方法研究.
(1)目前合成氨的技术原理为:(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/molN2
该反应的能量变化如图1所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是:______.(填“增大”、“减小”或“不变”).
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1mol,H2为0.3mol,NH3为0.1mol.该条件下H2的转化率为______.
③欲提高②容器中H2的转化率,下列措施可行的是______.
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨.其实验装置如图2所示.阴极的电极反应式为______.
(3)根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a______0.(填“大于”、“小于”或“等于”)
N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol
②已知
O2(g)+2H2(g)2H2O(l);△H=-571.6kJ/mol则2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=kJ/mol
(4)NH4Cl溶液呈酸性,这是由于N 水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是______.
水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是______.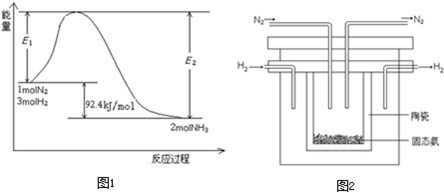
-
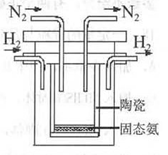
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
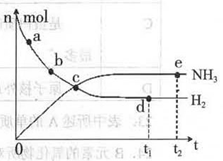
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。
-
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:
N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol
2NH3(g)+92.4 kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
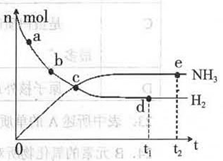
(1)下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:_____________。
2NH3(g)的平衡常数值为:_____________。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e 2H+,则阴极的电极反应为:_____________。
2H+,则阴极的电极反应为:_____________。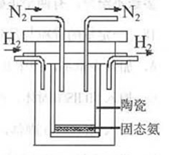
-
科学家一直致力于“人工固氨”的新方法研究.目前合成氨技术原理为:
N2(g)+3H2(g)⇌2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.
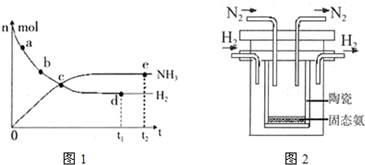
(1)下列叙述正确的是________
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)⇌2NH3(g)的平衡常数值为:________.
(3)K值越大,表明反应达到平衡时________.
A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:________.
-
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g) 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
| H-H | N-H | N-N | N≡N |
| 435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。
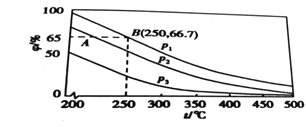
①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s) 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。
-
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为:N2(g)+3H2(g) 2NH3(g) △H
2NH3(g) △H
(1)已知破坏1mol共价键需要的能量如表所示
| H-H | N-H | N-N | N≡N |
| 435.5kJ | 390.8kJ | 163kJ | 945.8kJ |
则△H=__________。
(2)在恒温、恒压容器中,按体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将__________(填“增大”、“减小”、或“不变”,后同);若在恒温、恒容条件下c(N2)/c(NH3)将________。
(3)在不同温度、压强和使用相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol 时,平衡混合物中氨的体积分数(φ)如图所示。
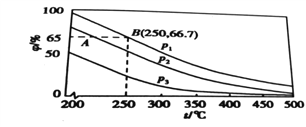
①其中,p1、p2和p3由大到小的顺序是_______,原因是___________________。
②若在250℃、p1条件下,反应达到平衡时的容器体积为1L,则该条件下合成氨的平衡常数K=____(结果保留两位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s) 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)
①每生成34g NH3的同时消耗44g CO2 ②混合气体的密度保持不变
③NH3的体积分数保持不变 ④混合气体的平均相对分子质量不变 ⑤c(NH3):c(CO2)=2:1
(5)科学家发现,N2和H2组成的原电池合成氨与工业合成氨相比具有效率高,条件易达到等优点。其装置如图所示、写出该原电池的电极反应:________________、_____________,若N2来自于空气,当电极B到A间通过2molH+时理论上需要标况下空气的体积为_________(结果保留两位小数)。

-
已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法.请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5min内,消耗N2的平均反应速率为______,此条件下该反应的化学平衡常数K=______;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正______v(N2)逆(填写“>”、“=”或“<”=).
②下列各项能作为判断该反应达到化学平衡状态的依据是______(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol,下列说法正确的是______.
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①各物质的平衡浓度可能是______.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:______.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:______.
(Ⅱ)a、b、c的关系:______.
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),此反应的△S______0(填“>”、“<”或“=”),△H=______.(已知:H2的燃烧热为285.8kJ/mol)
2NH3(g)ΔH=-92.4 kJ/mol,该反应的能量变化如图所示。

,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
4NH3(g)+3O2(g)
H2O(g) ΔH=+44.0 kJ/mol
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。










