-
“野火烧不尽,春风吹又生”是唐代诗人白居易的若名诗句。下列关于该诗句中所涉及的说法不正确的是
A.“野火烧”属于生物质能的热化学转换
B.自然界中“春风吹又生”涉及到太阳能与化学能之间的转化
C.诗句“春风吹又生”说明生物质能属于可再生的新能源
D.野草成份中的纤维素属于有机物,而火烧后草木灰中的主要成份K2CO3属于盐
难度: 简单查看答案及解析
-
下列有关物质性质与用途描述正确且具有对应关系的是
A.浓硫酸具有脱水性,可用作某些气体的干燥剂
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2具有还原性,可用作草帽、纸浆的漂白剂
D.12C的放射性,可用作考古断代
难度: 简单查看答案及解析
-
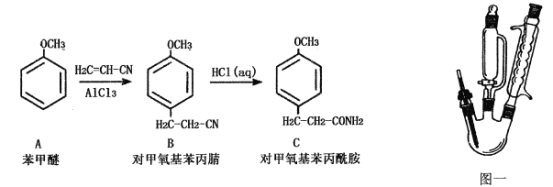
工业制备下列物质的方案中正确的是
A.
B.
C.
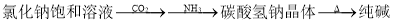
D.
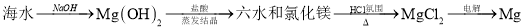
难度: 中等查看答案及解析
-
下列说法正确的是
A.利用红外光谱或核磁共振谱均可鉴别乙醇和二甲醚
B.2-甲基丁烷也称为异丁烷
C.C4H9Cl有3种同分异构体
D.葡萄糖、蔗糖不属于高分子化合物,而油脂和蛋白质均属于高分子化合物
难度: 简单查看答案及解析
-
2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。下列关于周期表、周期律叙述正确的是
A.离子半径:F->O2-
B.金属性:Al<81Tl
C.非金属性:Cl>S,故酸性:HCl>H2S
D.在同周期,第IIA族和第IIIA族元素原子序数相差可能为1、11、24
难度: 简单查看答案及解析
-
下列说法正确的是
A.NaOH在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性
B.足球烯(C60)的沸点可达500℃左右,故足球烯为原子晶体
C.干冰和NaCl晶体转变为液态时,需克服的作用力相同
D.NH3的熔沸点较PH3高,主要是因为N-H间共价键较强
难度: 中等查看答案及解析
-
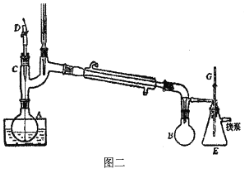
下列实验操作说法正确的是
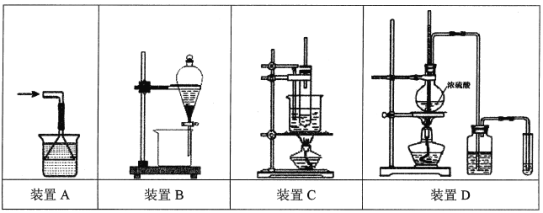
A.处理极易溶于水的气体尾气如NH3时,可选用装置A
B.萃取分离溴水中的Br2,可选用装置B,在萃取剂选择上可使用酒精、苯或CCl4
C.苯的硝化反应实验可选用装置C,反应前在试管中将1.5 mL浓HNO3和2 mL浓硫酸混合均匀,再快速倒入苯,防止其挥发
D.验证乙醇消去反应生成乙烯的实验可选用装置D,洗气瓶内需盛放NaOH溶液,反应开始时,加热烧瓶使混合液迅速上升到170℃
难度: 中等查看答案及解析
-
下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO32-=HCO3-
B.草酸(H2C2O4)溶液中加入酸性KMnO4溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1 mol浓硫酸与足量Mg完全反应,转移电子数可能为NA
B.14 g Si中含有化学键的数目为2NA
C.工业合成氨的反应中,消耗0.25 mol N2,可得NH3的分子数为0.5NA
D.标准状况下,22.4L乙烷和苯的混合物中含C-H键的数目为6NA
难度: 中等查看答案及解析
-
下列实验事实中,不能证明CH3COOH为弱酸的是
A.浓度均为0.100mol/L的盐酸溶液与醋酸溶液进行小灯泡实验,醋酸溶液灯泡较暗
B.厨房小实验:将鸡蛋壳浸泡到醋酸中,产生气泡
C.将0.0100 mol/L的醋酸溶液加水稀释100倍,测得其pH值大于5
D.CH3COONa溶液呈碱性
难度: 中等查看答案及解析
-
某二元酸(化学式用H2X表示)在水中的电离方程式是:H2X=H++HX- HX-
H++X2-,常温下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列叙述中正确的是
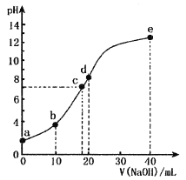
A.a点pH>1
B.b点溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X)>c(H+)>c(OH-)
C.d点溶液中:c(Na+)=2c(X2-)+2c(HX-)
D.水的电离程度:c>a>e
难度: 中等查看答案及解析
-
电解法转化CO2可实现CO2资源化利用,现电解CO2制HCOOH的原理示意图如图所示。下列说法不正确的是
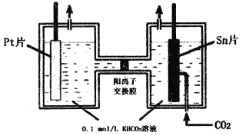
A.Sn片与电源负极相连,用多孔锡电极代替普通Sn片更好
B.右池电极方程式为:H2O+2CO2+2e+=HCOO-+HCO3-
C.左池中H2O发生电解生成O2,从而使该池中KHCO3溶液浓度升高
D.溶液中,K+从左池通过阳离子交换膜移向右池
难度: 中等查看答案及解析
-
生成水的能量关系如图所示:下列说法不正确的是
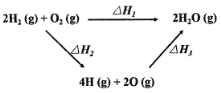
A.△H2>0
B.若2H2(g)+O2(g)=2H2O(l) △H4,则△H4<△H1
C.一定条件下,气态原子生成1 mol H-O放出a kJ热量,则该条件下△H3=-4akJ/mol
D.△H1+△H2+△H3=0
难度: 简单查看答案及解析
-
合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
难度: 中等查看答案及解析
-
某科研小组发现有机化合物A的结构如图所示:
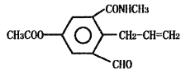
下列有关化合物A说法正确的是
A.化合物A的分子式为C14H13NO4
B.向化合物A中加入少量溴水,观察到溴水褪色,证明化合物A中含碳碳双键
C.1 mol化合物A最多可与3 mol NaOH溶液发生反应
D.化合物A可发生加成、氧化、缩聚、取代等反应
难度: 简单查看答案及解析
-
某溶液A中可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-、Fe2+和Fe3+离子中的若干种,现将溶液分成两等份进行如下实验:
(1)取一份溶液于试管中,滴加过量NaOH溶液,先产生沉淀而后沉淀部分溶解;过滤,将滤渣高温灼烧,往灼烧后的固体中加入稀硝酸,无气体产生。
(2)另取一份溶液于试管中,先加入BaCl2溶液,产生白色沉淀4.66g;过滤后,继续往滤液中加入足量硝酸酸化的AgNO3溶液,又产生白色沉淀5.74g。下列说法正确的是
A.溶液中一定不含NH4+,CO32-
B.溶液中可能含有Cu2+
C.溶液中一定含有Cl-,SO42-,且n(Cl-)=0.04 mol
D.溶液中可能含有Fe2+,Fe3+
难度: 中等查看答案及解析
-
氯化亚铜(CuCl)广泛应用于化工等行业,其难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图所示:

下列说法正确的是
A.步骤①,为加快海绵铜的溶解速度,可将其进行适当粉碎并用大火持续加热
B.步骤③主要离子方程式:H2O+2Cu2++SO32-+2Cl-=CuCl↓+SO42-+2H+
C.步骤⑤包括用pH=2的酸洗、水洗两步操作,为了防止CuCl被氧化,故不采用硝酸,而应采用硫酸或盐酸
D.步骤⑥中醇洗主要目的是去除CuCl表面水分,但在步骤⑦中仍需要烘干,故节约成本可删除醇洗操作
难度: 中等查看答案及解析
-
室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05 mol/L Ba(OH)2溶液,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法不正确的是
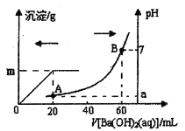
A.原混合液中盐酸物质的量浓度为0.2 mol/L
B.逐滴加入Ba(OH)2溶液,当体积为40 mL,此时发生的离子方程式:OH-+H+=H2O
C.生成沉淀的最大质量m=2.33g
D.现将上述20 mL酸混合溶液与60 mL Ba(OH)2溶液直接混合,发生的离子方程式:Ba2++6OH-+SO42-+6H+=BaSO4↓+6H2O
难度: 中等查看答案及解析
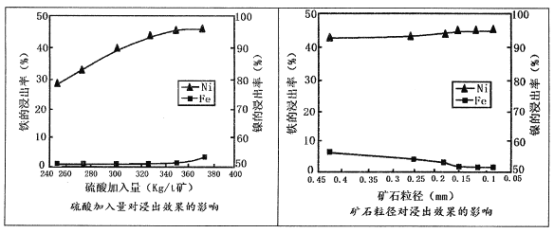
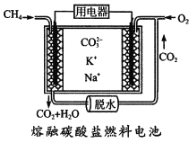
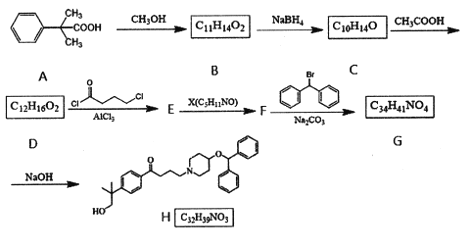
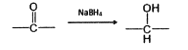
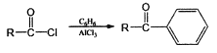
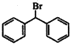 ,请设计出合成路径。___________
,请设计出合成路径。___________