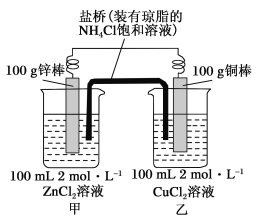
-
下列溶液中各微粒的浓度关系正确的是 ( )
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+): (NH4)2SO4> NH4HSO4> NH4Cl
C. 1.0mol/L Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3)
D. 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA—)+c(A2—)
难度: 中等查看答案及解析
-
有溶质的物质的量浓度均为0.1mol/L的下列八种溶液:①HCl、②H2SO4、③CH3COOH、④Ba(OH)2、⑤KOH、⑥NaF、⑦KCl、⑧NH4Cl。这些溶液的pH由小到大的顺序是( )
A.②①③⑧⑦⑥⑤④ B.②①③⑥⑦⑧⑤④
C.①②③⑧⑦⑥④⑤ D.②①⑧③⑦⑥④⑤
难度: 简单查看答案及解析
-
其他条件不变,升高温度,下列数据不一定增大的是( )
A.0.1 mol·L-1 CH3COONa溶液pH B.可逆反应的化学平衡常数K
C.弱电解质的电离程度 D.水的离子积常数KW
难度: 中等查看答案及解析
-
下列叙述中不能证明一元酸HA是弱电解质的方法是( )
A.足量锌与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
B.测得NaA溶液的pH>7
C.pH=1的HA溶液与盐酸稀释100倍后,盐酸的pH变化大
D.测得0.1 mol·L-1 HA的pH>1
难度: 中等查看答案及解析
-
废电池必须进行集中处理的问题被提到议事日程。其首要原因是( )
A.防止汞、镉和铅等重金属离子对土壤和水源的污染
B.为了利用电池外壳的金属材料
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
难度: 简单查看答案及解析
-
有关原电池的下列说法中正确的是( )
A.原电池可以把物质内部的能量全部转化为电能
B.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
C.在原电池中,电子流出的一极是负极,该电极被还原
D.构成原电池正极和负极的材料必须是金属,原电池中正极一定是不活泼金属
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.反应AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,可以设计成原电池
B.Zn-Cu原电池工作过程中,溶液中H+向负极做定向移动
C.把铁片和铜片放入稀硫酸中,并用导线把二者相连,观察到铜片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.所有的化学反应都有能量变化
B.自发反应在恰当条件下才能实现
C.使用催化剂可以降低反应的活化能,增大化学反应速率,从而提高反应物的转化率
D.升高温度,活化分子百分数增大,化学反应速率一定增大
难度: 简单查看答案及解析
-
在2A + B = 3C + 4D的反应中,下列表示该反应速率最大的是( )
A. VA =0.5mol / (L·min) B. VB =0.3mol / (L·min)
C. Vc=0.8mol / (L·min) D. VD = 1mol / (L·min)
难度: 中等查看答案及解析
-
对于可逆反应C(s)+H2O(g)
CO(g)+H2(g),下列说法不能证明反应已达平衡状态的是( )
A.绝热容器,温度不再改变
B.恒容时,压强不再改变
C.恒压时,体积不再改变
D.断裂2 mol O—H键同时形成1 mol H—H键
难度: 中等查看答案及解析
-
在一密闭容器中,当反应aA(g)
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
难度: 中等查看答案及解析
-
把1 L 0.1 mol·L-1醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A.
的比值增大 B.c(CH3COOH)变为原来的
C.溶液的导电性增强 D.c(H+)变为原来的
难度: 中等查看答案及解析
-
如图所示曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
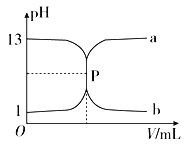
A.P点时恰好完全反应,溶液呈中性
B.盐酸的物质的量浓度为1 mol·L-1
C.酚酞不能用作本实验的指示剂
D.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
难度: 中等查看答案及解析
-
室温下由水电离产生的c(H+)=10-12 mol·L-1的溶液中,一定能大量共存的离子组是( )
A.NH、Ba2+、Cl-、NO3- B.Cl-、SO42-、Na+、K+
C.Na+、K+、ClO-、OH- D.SO42-、NO3-、Fe2+、Mg2+
难度: 中等查看答案及解析
-
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,Ksp(Ag2CrO4)=1.1×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4 B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
难度: 简单查看答案及解析
-
Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) ⇌ Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析