-
生产、生活离不开化学,下列说法不正确的是( )
A. 泡沫灭火器的反应原理是非氧化还原反应
B. 钢铁析氢腐蚀和吸氧腐蚀的速率一样快
C. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
D. 燃料电池的燃料都在负极发生反应
难度: 简单查看答案及解析
-
关于恒容密闭容器进行的反应C(s)+ CO2(g)= 2CO(g)△H >0,下列说法不正确的是
A. △S>0
B. 在低温下能自发进行
C. 当混合气体的密度不再发生变化时,反应达到平衡状态
D. 达到平衡状态时,升高温度, CO2转化率和反应速率均增大
难度: 困难查看答案及解析
-
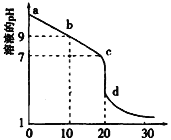
常温下,下列事实能说明HClO是弱电解质的是
A.0.01mol/L的HClO溶液pH>2
B.NaClO、HClO 都易溶于水
C.HClO 不稳定,见光或受热易分解
D.HClO 与Na2SO3溶液反应,可以得到Na2SO4
难度: 中等查看答案及解析
-
500 mL 1 mol/L的稀HCl与锌粒反应,下列措施不会使反应速率加快的是
A.升高温度
B.加入少量的铜粉
C.将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl
D.用锌粉代替锌粒
难度: 简单查看答案及解析
-
在下列各溶液中,一定能大量共存的离子组是
A.常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B.滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3-
C.使石蕊呈红色的溶液:NH4+、NO3﹣、AlO2﹣、I﹣
D.常温下
=1014的溶液中:K+、Ba2+、Cl-、Br-
难度: 中等查看答案及解析
-
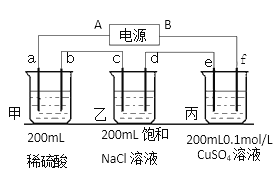
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
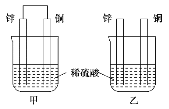
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )
A.向水中加入少量的CH3COONa B.向水中加入少量的NaHSO4
C.加热水至100 ℃,pH=6 D.向水中加少量的明矾
难度: 简单查看答案及解析
-
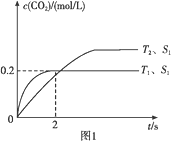
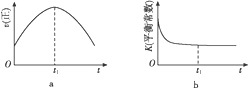
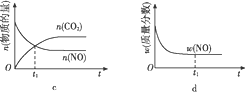
用来表示可逆反应2A(g)+B(g)
2C(g) ΔH<0的正确图像是( )
A.
 B.
B. 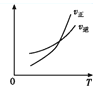 C.
C. 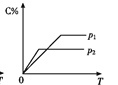 D.
D. 
难度: 中等查看答案及解析
-
下面提到的问题中,与盐的水解有关的是
①明矾可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③NH4Cl溶液可作焊接中的除锈剂
④实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞而不能用玻璃塞
A.①④ B.②③ C.③④ D.全部
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.碳酸钠溶液显碱性 CO32-+H2O
H2CO3+2OH-
B.Fe2+与H2O2在酸性溶液中的反应 2Fe2++H2O2+2H+=2Fe3++2H2O
C.用惰性电极电解MgCl2 溶液 2Cl-+2H2O
Cl2↑+H2↑+2OH-
D.用FeCl3溶液腐蚀铜箔制作印刷电路板 Fe3++Cu═Cu2++Fe2+
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结 论
A
向一定浓度的Na2SiO3 溶液中通入适量CO2 气体, 出现白色沉淀。
H2SiO3 的酸性比H2CO3的酸性强
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
室温下,测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。
HSO3- 结合H+ 的能力比SO32-的强
D
分别向25mL冷水和25mL沸水中滴入6滴FeCl3 饱和溶液,前者为黄色,后者为红褐色。
温度升高,Fe3+的水解程度增大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是
A.等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
B.化学反应A2(g)+2B2(g)===2AB2(g)能量变化如图所示,该反应为放热反应
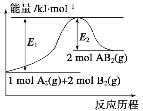
C.在25℃、101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)
2H2O(l)△H= -285.8kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)
H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
难度: 中等查看答案及解析
-
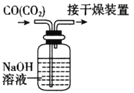
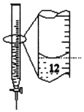
下列有关实验的选项正确的是
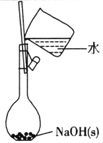
A.配制0.l0mol/L NaOH溶液
B.除去CO中的CO2
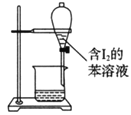
C.苯萃取碘水中的I2,分出水层后的操作
D.记录滴定终点读数为12.20mL
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,下列溶液中各离子浓度关系正确的是
A.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.浓度为0.1mol·L-1的碳酸钠溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
D.醋酸溶液与NaOH溶液混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析
-
根据键能数据估算CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为
化学键
C—H
C—F
H—F
F—F
键能/(kJ
mol-1)
414
489
565
155
A. -485 kJ
mol-1 B. +485 kJ
mol-1 C. +1940 kJ
mol-1 D. -1940 kJ
mol-1
难度: 简单查看答案及解析
-
在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
难度: 简单查看答案及解析