-
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO4-被还原成Mn2+。重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液分别为19.98 mL和20.00 mL。请回答下列问题:
(1)滴定过程中,高锰酸钾溶液应盛装在__________滴定管中(填“酸式”或“碱式”)。
(2)用离子方程式表示步骤二中涉及到的相关化学反应:________________; Zn + 2Fe3+ = 2Fe2+ + Zn2+。
(3)步骤三中滴定终点的判定:____________________。
(4)在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量____________。在步骤三中,若滴定前仰视读数,滴定后俯视读数,则测得的铁含量__________。(选填“偏低”、“偏高”、“不变”)
(5)实验测得该晶体中铁的质量分数为__________。
高二化学实验题中等难度题查看答案及解析
-
(14分)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
Ⅰ.称量4.910g三草酸合铁酸钾晶体,配制成250mL溶液。
Ⅱ.取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根(C2O42−)恰好全部氧化成二氧化碳,同时MnO4−被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液的黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
Ⅲ.用0.01000mol/L KMnO4溶液滴定步骤Ⅱ所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4−被还原成Mn2+ 。
Ⅳ.重复步骤Ⅱ、步骤Ⅲ操作,滴定消耗0.01000mol/L KMnO4溶液19.98mL
请回答下列问题:
(1)滴定过程中需添加的指示剂是(若不需要请说明理由)
(2)加入锌粉的目的是 。
(3)写出步骤Ⅲ中发生反应的离子方程式 。
(4)实验测得该晶体中铁的质量分数为 ;X= 。
(5)在步骤Ⅱ中,若加入的KMnO4的溶液的量不够,则测得的铁含量 ;(选填“偏低”“偏高”“不变”,下同)若加入的锌粉的量不够,则测的铁的含量 。
高二化学实验题困难题查看答案及解析
-
三草酸合铁酸钾晶体(K3[Fe(C2O4) 3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、 、转移、洗涤并转移、 摇匀。
②加入锌粉的目的是 。
③写出步骤三中发生反应的离子方程式 。
④实验测得该晶体中铁的质量分数为 。在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量 。(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩锅中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误: ; 。
高二化学实验题简单题查看答案及解析
-
三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·xH2O}是一种光敏材料,为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量4.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO
被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO
被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 mL。
请回答下列问题:
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、________、转移、洗涤并转移、________、摇匀。
(2)加入锌粉的目的是________________ ___。
(3)写出步骤三中发生反应的离子方程式:________________________。
(4)实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量________。(选填“偏低”、“偏高”或“不变”)
高二化学实验题困难题查看答案及解析
-
三草酸合铁酸钾晶体[K3Fe(C2O4)3•xH2O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820 g三草酸合铁酸钾晶体,配制成250 mL溶液。(2)取所配溶液25.00 mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0. 1000 mol/L KMnO4溶液24.00 mL。[K3Fe(C2O4)3的相对分子质量为437] 下列说法正确的是
A.步骤(2)中KMnO4表现还原性
B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒
C.样品中结晶水的物质的量为0.03 mol
D.该晶体的化学式为K3Fe(C2O4)3•3H2O
高二化学选择题中等难度题查看答案及解析
-
三草酸合铁酸钾晶体[K3Fe(C2O4)3•xH2O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:
(1)称量9.820g三草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0.1000mol/LKMnO4溶液24.00mL.[K3Fe(C2O4)3的相对分子质量为437]
下列说法正确的是( )
A.步骤(2)中KMnO4表现还原性
B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒
C.样品中结晶水的物质的量为0.03 mol
D.该晶体的化学式为K3Fe(C2O4)3•3H2O高二化学选择题中等难度题查看答案及解析
-
草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号
KMnO4溶液的浓度(mol/L)
KMnO4溶液滴入的体积(mL)
1
0.0200
V1 = 20.02
2
0.0200
V3 = 19.98
3
0.0200
V2 = 23.32
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。
高二化学实验题中等难度题查看答案及解析
-
测定三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)晶体中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_______________________________________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为______________________。
高二化学填空题简单题查看答案及解析
-
草酸合铁(Ⅲ)酸钾晶体[KxFe y(C2O4)z•nH2O]是一种光敏材料,为测定该晶体中各离子的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820g草酸合铁酸钾晶体,加热脱水得无水物质量为8,74g.(2)将所得固体配制成250mL溶液.(3)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液发生反应:5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O,恰好消耗0.1000mol/L KMnO4溶液24.00mL.下列说法正确的是
A.9.820g晶体中含有C2O42﹣的物质的量为0.006mol
B.配制草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒
C.该晶体的化学式为K3Fe(C2O4)3•6H2O
D.9.820g样品中含K+的物质的量为0.06 mol
高二化学选择题困难题查看答案及解析
-
通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
①称取2.52 g草酸晶体,配制成100 .00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
(1)实验②中,KMnO4应装在______滴定管中(填“酸式”、“碱式”)。
(2)如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______。
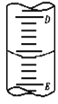
A.是amL B.是(50-a)mL
C.一定大于amL D.一定大于(50-a)mL
(3)判断达到滴定终点的现象是_____________________________;
若滴定终点时,共用去KMnO4溶液20.00 mL,则x =__________。
(4)若在滴入KMnO4溶液之前滴定管的尖嘴部分有气泡,滴定结束后气泡消失,则会使测定结果______(偏高、偏低或无影响)。
高二化学填空题中等难度题查看答案及解析