-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液
A.HCOONa B.NaCN C.Na2CO3,
其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为__________________________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是:
______________________________,溶液中 =___________。
=___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
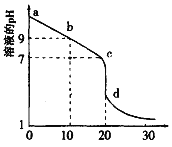
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中 =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液
A.HCOONa B.NaCN C.Na2CO3,
其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为__________________________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是:
______________________________,溶液中 =___________。
=___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
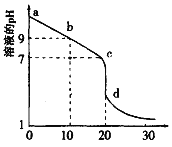
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中 =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________________。
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是___________;此时c(HCN)/c(CN-)=______________。
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为__________ mol/L。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____。
③向NaCN溶液通入少量CO2反应的化学方程式是_______。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____,此时, =_____。
=_____。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
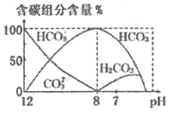
回答下列问题:
在同一溶液中H2CO3、 、
、 ______(填“能”或“不能”)大量共存。
______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____,溶液中各种离子( 除外)的物质的量浓度的大小关系为______。
除外)的物质的量浓度的大小关系为______。
③已知在25℃时, 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh= =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c( ):c(
):c( )=2:1时,溶液pH=______。
)=2:1时,溶液pH=______。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________mol/L。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________;
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
③向 NaCN溶液通入少量CO2反应的化学方程式是_______________________________;
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是________________;此时c(HCN)/c(CN-)=________________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是_____________________________。
(3)已知CaCO3的KSp=2.8×l0- 9,现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为____________mol/L。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
Ⅰ. 已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka= 1.77×10-4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
(1)0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
(2)常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
(3)室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是___________。
Ⅱ. 室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
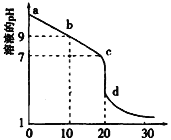
(4)d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
(5)b点所示的溶液中c(NH3·H2O) - c(NH4+)=______(用溶液中的其它离子浓度表示)。
Ⅲ. 已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
(6)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中 =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。②常温下,pH相同的三种溶液A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2O(1) △H=-akJ/mol,H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol,醋酸电离的热化学方程式为________________________________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________________。
⑤室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是________________,溶液中c(CH3COO—)/c(CH3COOH)___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
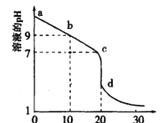
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=__________(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
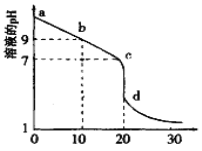
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。

=___________(保留三位有效数字)。




