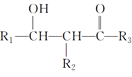-
宋应星所著《天工开物》被外国学者誉为“17世纪中国工艺百科全书”。下列说法不正确的是
A.“凡白土曰垩土,为陶家精美启用”中“陶”是一种传统硅酸盐材料
B.“凡火药,硫为纯阳,硝为纯阴”中“硫”指的是硫磺,“硝”指的是硝酸
C.“烧铁器淬于胆矾水中,即成铜色也”该过程中反应的类型为置换反应
D.“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”中的黄铜是合金
难度: 中等查看答案及解析
-
某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是
A.不能使酸性KMnO4溶液褪色
B.1 mol该物质最多能和4mol H2发生加成反应
C.分子中所有原子共平面
D.易溶于水及甲苯
难度: 简单查看答案及解析
-
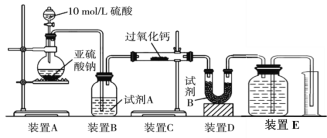
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
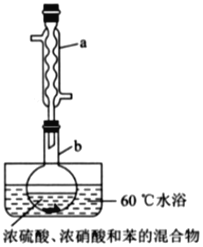
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
难度: 中等查看答案及解析
-
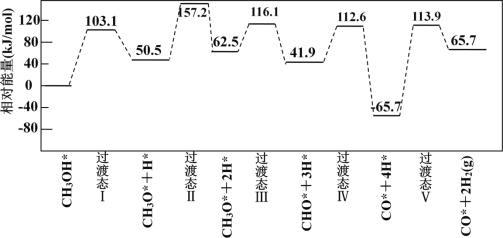
多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现T°C时,甲醇(CH3OH)在铜基催化剂上的反应机理如下:
反应I: CH3OH(g)=CO(g)+2H2 (g) ∆H1=a kJ/mol
反应Ⅱ: CO(g)+H2O(g)=CO2 (g)+H2 (g) ∆H2=-b kJ/mol (b>0)
总反应: CH3OH(g)+H2O(g)=CO2 (g)+3H2(g) ∆H3= c kJ/mol
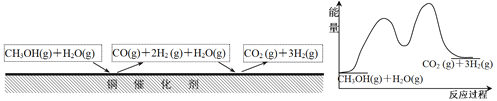
下列有关说法中正确的是( )
A.反应I是放热反应
B.1mol CH3OH(g)和H2O(g)的总能量大于1mol CO2(g)和3mol H2(g)的总能量
C.c>0
D.优良的催化剂降低了反应的活化能,并减少∆H3,节约了能源。
难度: 简单查看答案及解析
-
已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式
HA
H2B
电离平衡常数(25 ℃)
Ka=1.7×10-6
Ka1=1.3×10-3 Ka2=5.6×10-8
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
难度: 简单查看答案及解析
-
利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( )
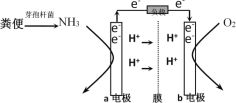
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
难度: 简单查看答案及解析
-
2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为
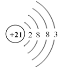
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
难度: 简单查看答案及解析