-
实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
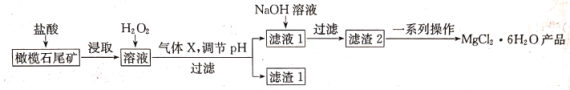
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有______________________(任写两种)。
(2)气体X的电子式为___________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)加入H2O2的目的是___________;若将上述过程中的“H2O2”用“ NaClO”代替也能达到同样目的,则发生反应的离子方程式为_________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过______________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,加入100mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断震荡下,用0.5000mol·L-1的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4-=MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00mL。
①则产品中MgCl2·6H2O的质量分数为___________(结果保留3位有效数字)。
②下列滴定操作会导致测量结果偏高的是___________(填宇母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数 d滴定管滴定前有气泡,滴定后气泡消失
-
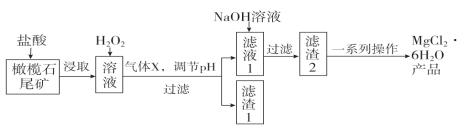
实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
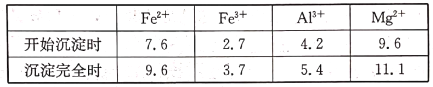
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失
-
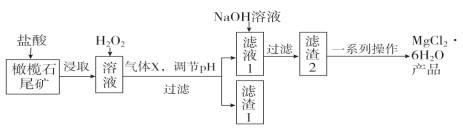
实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失
-
(13分)氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
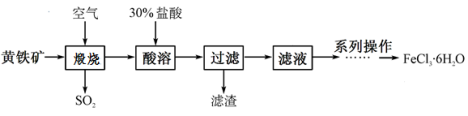
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
-
古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:

金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Mg2+ | 7.6 | 9.4 |
| Fe2+ | 6.5 | 9.9 |
| Fe3+ | 1.5 | 3.3 |
| Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。

x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
-
实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
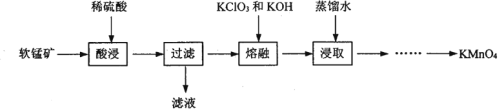
(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。
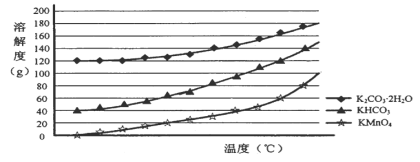
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
-
实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
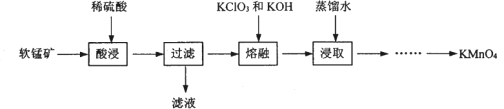
(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。
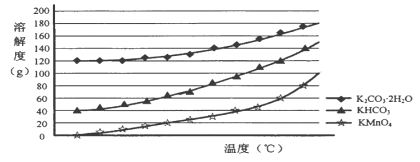
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
-
某工厂废金属屑中主要成分为Cu、Fe和Al(含有少量Al2O3和Fe2O3),某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
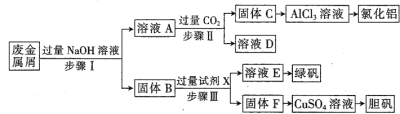
请回答:
(1)胆矾的化学式为___________________。
(2)溶液E为绿色溶液,则试剂X是______________。
(3)步骤I,首先加入温热NaOH溶液,作用是_________;-段时间后,再分批加入常温NaOH溶液,原因是___________。
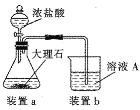
(4)在步骤II时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和_________溶液的洗气瓶。
(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量_______(填化学式),防止变质。
-
某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:
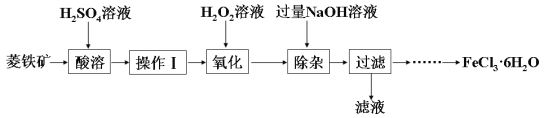
(1)酸溶及后续过程中均需保持酸过量,其目的除了提高铁元素的浸出率之外,还有______。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为______________________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_____________________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体__________,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
-
某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:
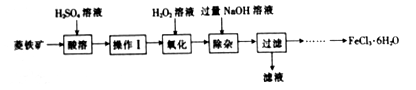
(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。














