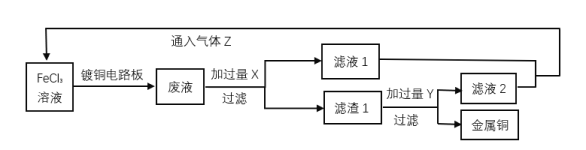
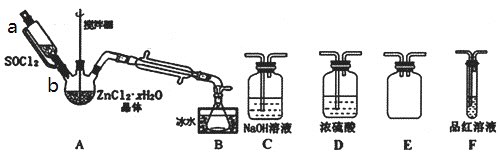
-
化学与生产、生活、科技等密切相关,下列说法错误的是( )
A.开发利用太阳能、风能和氢能等新能源代替化石能源,利于实现低碳经济
B.利用膜材料将含油污水中的油水分离,发生的是化学变化
C.依照Cu
CuO
Cu(NO3)2的反应制取Cu(NO3)2符合不易产生污染的绿色化学理念
D.屠呦呦从青蒿中提取青蒿素对治疗疟疾有特效
难度: 简单查看答案及解析
-
我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。……。虚弱者忌之。宜外用,勿服。……。”这里的“鼻冲水”是指( )
A.醋 B.硝酸 C.食盐水 D.氨水
难度: 简单查看答案及解析
-
在下列物质分类中,前者包含后者的是( )
序号
前者
后者
序号
前者
后者
A
电解质
化合物
B
金属氧化物
碱性氧化物
C
分散系
混合物
D
单质
纯净物
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,下列物质中不能用铁质容器贮运的是( )
A.浓盐酸 B.浓硝酸 C.液氯 D.浓氨水
难度: 简单查看答案及解析
-
下列关于自然界中氮循环(如图)的说法错误的是( )

A.碳、氢、氧三中元素也参加了氮循环
B.含氮的无机物和含氮的有机物可以相互转化
C.仿生固氮和根瘤菌固氮均为天然固氮
D.氮元素有的发生氧化反应,有的发生还原反应
难度: 简单查看答案及解析
-
进行化学实验时应强化安全意识。下列做法正确的是( )
A.金属钠着火时使用干粉(主要成分为碳酸氢钠)灭火器灭火
B.用试管加热固体时使用试管口向上倾斜
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.移取熔融氯化钠的坩埚,应用坩埚钳夹持
难度: 简单查看答案及解析
-
将盛有浓硫酸和浓盐酸的两烧杯分别在空气中放置一段时间。下列说法正确的是( )
A.浓盐酸和浓硫酸的浓度都减小 B.浓盐酸和浓硫酸的质量都减小
C.浓盐酸和浓硫酸的质量都增加 D.浓盐酸和浓硫酸的浓度都增加
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.硫元素的同素异形体的性质相同
B.H2O2常做氧化剂,只有氧化性
C.向CaCl2溶液中通入CO2气体,有白色沉淀生成
D.汽车尾气中的NO主要是氮气和氧气在汽车汽缸中形成的
难度: 简单查看答案及解析
-
有一瓶可能部分被氧化的Na2SO3溶液,某同学取少量此溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是( )
A.Na2SO3已部分被空气中的氧气氧化
B.加入 Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加足量硝酸后的白色沉淀一定是BaSO4
D.此实验能确定Na2SO3是否部分被氧化
难度: 中等查看答案及解析
-
Zn与硝酸反应时,硝酸溶液的浓度不同,产物也不相同。与不同浓度硝酸反应时,反应的Zn与被还原硝酸的物质的量关系如图。还原产物为NH4NO3的曲线是( )

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
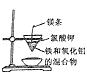
下列实验操作正确且能达到实验目的的是( )
A.发生铝热反应
 B.形成红色喷泉
B.形成红色喷泉
C.配制100mL一定物质的量浓度盐酸
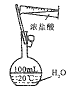 D.制取氨气
D.制取氨气
难度: 简单查看答案及解析
-
下列事实的解释中,错误的是( )
A.SO2的漂白原理与Ca(ClO)2水溶液、H2O2和氯水三种物质的不同
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
C.浓硫酸做干燥剂,是因为浓硫酸具有吸水性
D.SO2能使氯水褪色,SO2表现出漂白性
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.向FeCl3溶液中滴加KI溶液:2Fe3++2I-=2Fe2++I2
B.向氢氧化铜悬浊液中滴加稀硫酸:OH-+H+=H2O
C.过氧化氢使酸性高锰酸钾溶液褪色:H2O2+2MnO4-+6H+=4H2O+2Mn2++3O2↑
D.向NaHCO3溶液滴加少量澄清石灰水中:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析