-
亚硫酰氯(SOC12)又名氯化亚砜,其熔点一105℃,沸点79℃,140℃以上时易分解。是一种无色或淡黄色发烟液体,遇水剧烈与水反应生成SO2和另一酸性气体,常用作脱水剂,广泛应用于医药、农药、来料工业及有机合成工业。
(1)氯化亚砜储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是___;用硫黄、液氯和三氧化硫为原料在一定条件可合成氯化亚砜,如果想达到原子利用率最大化,则三者的物质的量之比为___。
(2)实验室合成SOCl2的原理之一为SO2+Cl2+SCl2 2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
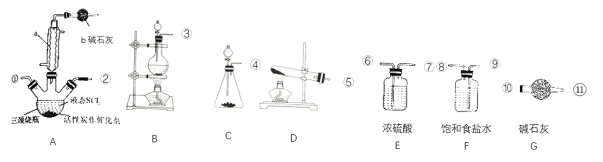
①装置b的作用是___。
②实验室制取SOCl2所选仪器的链接顺序:③→___。
(3)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。选用装置如图: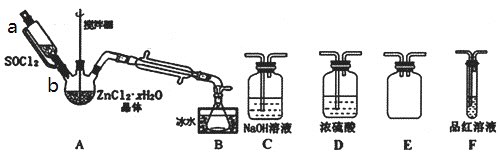
①向仪器A中缓慢滴加SOCl2,需打开活塞___(填“a”、“b”或“a和b”)。
②为了更加充分的回收SOCl2,写出可对装置B采取的有效措施___。
(4)乙同学认为利用(3)中装置,由FeCl3·6H2O制取无水FeCl3也可用SOCl2作脱水剂,但丙同学认为会发生氧化还原反应而难以制无水FeCl3。丙同学设计了如下实验方案验证自己的观点:
取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,加入___,证明该过程发生了氧化还原反应。
-
二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
(1)写出SOCl2吸收水蒸气的化学方程式:_________________
(2)甲同学设计如图所示装置,用ZnCl2·xH2O晶体制取无水ZnCl2、回收SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→______→_____→_____。(填字母)
②冷凝管的作用是____________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体a g溶于水,加入足量稀硝酸和硝酸银溶液,过滤、冼绦、干燥,称得固体为b g。若 =___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
=___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
(3)乙同学认为SOCl2 还可用作由FeCl3·6H2O 制取无水FeCl3 的脱水剂,但丙同学认为该实验中会发生氧化还原反应。请你设计并简述实验方案判断丙同学的观点:____________。
-
二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
(1)写出SOCl2吸收水蒸气的化学方程式:_________________
(2)甲同学设计如图所示装置,用ZnCl2·xH2O晶体制取无水ZnCl2、回收SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→______→_____→_____。(填字母)
②冷凝管的作用是____________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体a g溶于水,加入足量稀硝酸和硝酸银溶液,过滤、冼绦、干燥,称得固体为b g。若 =___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
=___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
(3)乙同学认为SOCl2 还可用作由FeCl3·6H2O 制取无水FeCl3 的脱水剂,但丙同学认为该实验中会发生氧化还原反应。请你设计并简述实验方案判断丙同学的观点:____________。
-
氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H= -97.3kJ/mol
SO2Cl2(l) △H= -97.3kJ/mol
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是______(填写序号)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)已知20℃时,AgCl的溶解度为0.00015 g,Ag2SO4的溶解度为0.796 g。则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是____________。
(3)300℃时,体积为1L的密闭容器中充入a mol SO2Cl2,达到平衡时容器中含SO2 b mol,则300℃时合成SO2Cl2反应的平衡常数为_____________。
(4)将(3)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量(写出计算过程)________
-
(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。

(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
(2)装置a中应放试剂为 ,其作用为 ;装置c为何水平放置 ;
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为 。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 。
-
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装 置均已略去)。

(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式_______;
(2)装置a的作用为_______;装置c为何水平放置_______;
(3)该实验的操作顺序应为_______(用序号表示);
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为_______,其作用为________;
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式________。
-
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题:
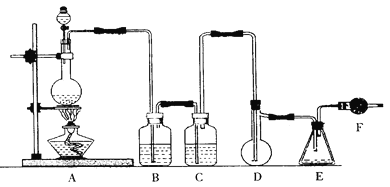
(1)装置A中发生反应的化学方程式为 。
(2)装置B、C应盛放的药品分别是 、 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用的措施是 、如何防止E中液体挥发? 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
-
(14分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。试回答下列问题:
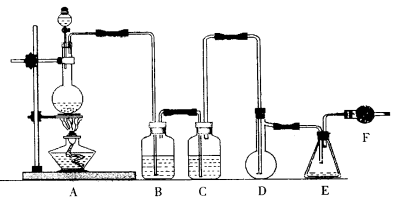
(1)装置A中发生反应的化学方程式为 。
(2)装置C盛放的药品是 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用 方式加热。
(5)F装置中干燥管内所装物质的作用是 。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
(7)在配制一定物质的量浓度的盐酸溶液时,下列操作所配溶液浓度偏低的是 :
A.配制溶液时,容量瓶中有少量水。
B.使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切
C.配制好溶液后,容量瓶未塞好,洒出一些溶液。
D.发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度
-
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。

试回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)装置B应盛放的药品是 ,C中是 。
(3)实验开始前先在D中放一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用 方式加热。
(5)二氯化硫分子中各原子均为8电子稳定结构,其电子式为 。
(6)在配制一定物质的量浓度的盐酸溶液时,下列操作所配溶液浓度偏低的是___________:
A.配制溶液时,容量瓶中有少量水。
B.使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切
C.配制溶液的过程中,容量瓶未塞好,洒出一些溶液。
D.发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线
-
四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)A处分液漏斗上方的胶皮管的作用是______________________________________。
(2)实验中B装置中选用的试剂为________,该装置的作用是___________________。
(3)写出D中物质制备的化学方程式_______________________________________;写出四氯化钛在空气中发烟的化学方程式_________________________________。
(4)E处球形冷凝管的作用是____________________________________________,该装置冷却水应从________(填“c”或“d”)口通入。
(5)仪器F中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处__________________________________。
2SOCl2,部分装置如图所示。









