-
化学与生活密切相关。下列物质的用途错误的是
A. 小苏打用于面包发酵
B. 氢氧化铝用于中和胃酸
C. 肥皂水用于蚊虫叮咬处清洗
D. 福尔马林用于食品保鲜
难度: 简单查看答案及解析
-
下列说法正确的是
A. HOCH2CH=CHCOOH能发生酯化、加聚、水解等反应
B. 石油分馏产品经过裂解、加成反应可制得乙醇
C. 丁烷的一氯代物有5种
D. 油脂、淀粉、蛋白质均是可发生水解反应的高分子化合物
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述不正确的是
A. 46g乙醇完全燃烧,转移的电子数为12NA
B. 0.2NA个CH4分子与足量氯气反应,生成物在标准状况下的体积为22.4L
C. 1L 1 mol·L-1NH4NO3 溶液中NO3-的数目为NA
D. 1mol Na与足量O2反应,产物中阴离子的数目为0.5NA
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期元素,X和W为同族元素,WX是离子化合物,YZ为常见气体。下列说法一定正确的是
A. 常温下,YZ在空气中易被氧气氧化
B. Y的最简单气态氢化物与其最高价氧化物的水化物能发生反应
C. 原子半径由大到小的顺序为W、Y、Z、X
D. 符合分子式为Y2X6Z的化合物能与W单质发生置换反应
难度: 中等查看答案及解析
-
如图所示为盐酸介质中,金属铜与氢叠氮酸(HN3)构成的原电池,总反应方程式为: 2Cu+2Cl- +HN3+3H+=2CuCl(s)+N2↑+NH4+。下列叙述错误的是
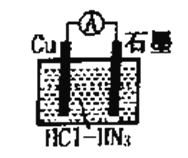
A. 电子的流向为Cu→
→石墨
B. 负极的电极反应式为Cu+Cl――e-=CuCl(s)
C. 反应一段时间后正极区溶液的pH减小
D. 标准状况下,生成224mL N2时,铜转移的电子数为0.02NA
难度: 中等查看答案及解析
-
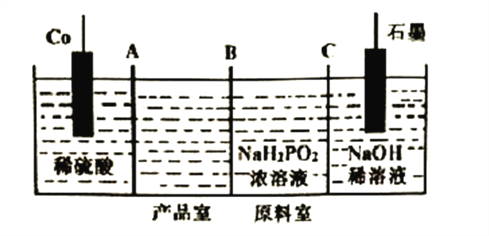
四氯化钛(TiCl4)极易水解,遇空气中的水蒸汽即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点 136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是
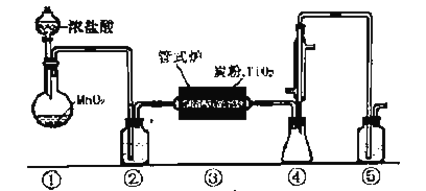
A. ②、⑤中分别盛装饱和食盐水和NaOH溶液
B. 冷凝管有冷凝、回流和导气的作用
C. 反应结束时,应先停止③处加热,后停止①处加热
D. 该设计存在不足,如④⑤之间缺少防水蒸汽进入④的装置
难度: 中等查看答案及解析
-
常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是
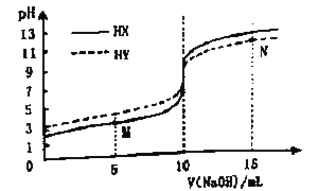
A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
难度: 中等查看答案及解析
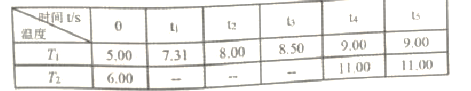
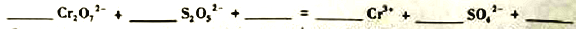
 ,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。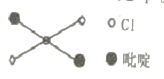
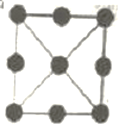

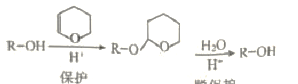
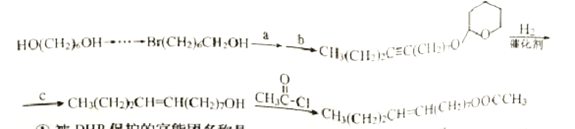
 )
)