-
下列有关说法正确的是
A. 常温下,0.1mol/LNH4Cl溶液的pH=1
B. 工业上电解饱和食盐水时,以石墨为阴极,铁棒为阳极
C. 铅蓄电池放电时,正极电极反应为:PbO2+SO42-+4H++2e-=PbSO4+2H2O
D. 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl)减小
难度: 困难查看答案及解析
-
已知:C(s)+ H2O(g)== CO(g) + H2(g) △H = a kJ·mol-1
2 C(s)+ O2(g)== 2CO(g) △H = -220 kJ·mol-1
H-H 、O=O和O-H键的键能(kJ·mol-1)分别为436、496和462,则a为( )
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒
微粒直径约为2.5×106m)分散在空气中形成气溶胶
难度: 简单查看答案及解析
-
如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
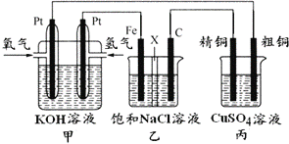
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
如图所示,甲池的总反应式为:
,下列关于该电池工作时的说法正确的是
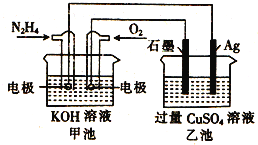
A.该装置工作时,Ag电极上有气体生成
B.甲池中负极反应为
C.甲池和乙池中的溶液的pH均减小
D.当甲池中消耗
时,乙池中理论上最多产生
固体
难度: 中等查看答案及解析
-
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )
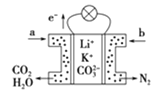
A.a为C4H10,b为CO2
B.在熔融电解质中,CO32-向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.5.6g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0、ΔS>0
C.电解精炼铜过程中,电路中每通过2mol电子,阳极溶解铜64g
D.0.1mol·L-1Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO3-)
难度: 中等查看答案及解析
-
下列实验事实得出的相应结论不正确的是
选项
事实
结论
A
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短
当其他条件不变时,升高反应温度,化学反应速率加快
B
向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色
Ksp:AgCl>AgI
C
2NO2(g)
N2O4(g),加压气体颜色加深
加压平衡向着气体颜色加深的方向移动
D
将MgCl2溶液蒸干后灼烧,得到MgO固体
蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下表是3种物质的溶解度(20 ℃),下列说法中正确的是( )
物质
MgCl2
Mg(OH)2
MgCO3
溶解度(g/100 g)
74
0.000 84
0.01
A.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6
B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
D.用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-===CaCO3↓+MgCO3↓+2H2O
难度: 中等查看答案及解析
-
下列图示与对应叙述相符的是
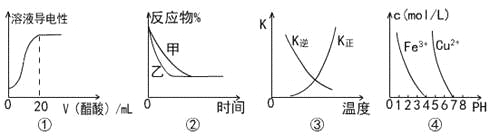
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
难度: 中等查看答案及解析
-
肼(N2H4)又称联氨,常用作火箭推进器的燃料。已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+182kJ·mol-1;
②2NO(g) +O2(g)=2NO2(g) ΔH2=-114.3kJ·mol-1;
③2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH2=-1135.7kJ·mol-1。
下列说法正确的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-1068kJ·mol-1
B.用铂作电极,以KOH溶液为电解液的肼
空气燃料电池,放电时的负极反应为N2H4-4e-+4OH-=N2+4H2O
C.肼与氨类似,溶于水显碱性,可表示为N2H4+H2O=N2H5++OH-
D.某密闭容器中存在:2NO2(g)
N2O4(g),加压
缩小体积
后颜色先变深后变浅,不能用勒夏特列原理解释
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
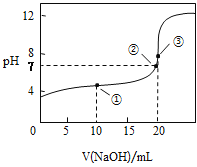
25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
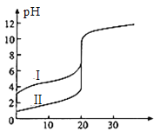
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
难度: 中等查看答案及解析
-
结合下图判断,下列叙述正确的是
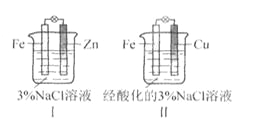
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液(此溶液遇Fe2+产生蓝色沉淀),均有蓝色沉淀
难度: 中等查看答案及解析
-
如图,下列各情况,在其中Fe片腐蚀由慢到快的顺序是( )
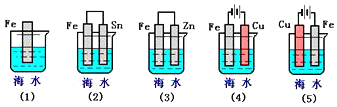
A.⑤②①③④ B.⑤①②④③ C.④②①③⑤ D.④③①②⑤
难度: 中等查看答案及解析