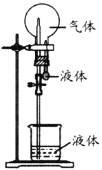
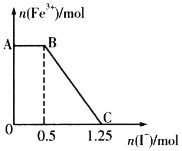
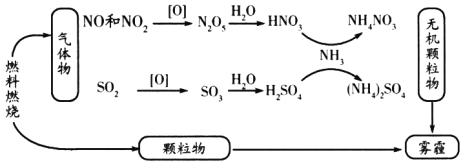
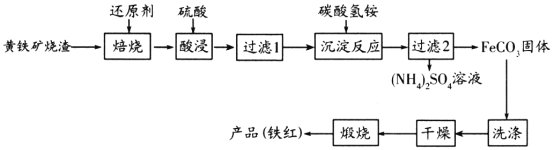
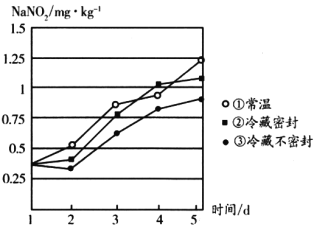
-
化学与生产和生活密切相关。下列说法错误的是
A.铁粉作食品袋内的脱氧剂,起还原作用
B.大量排放二氧化碳可导致温室效应
C.从海水中提取物质都必须通过化学反应才能实现
D.“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是K2CO3
难度: 简单查看答案及解析
-
据统计,约有80%~85%的化工生产过程使用催化剂,同样在化学实验室进行物质的制取时,也用到催化剂。以下反应不使用催化剂能顺利进行的是
A.实验室用过氧化氢制取氧气 B.实验室制取氯气
C.工业上合成氨 D.工业上制备硫酸
难度: 简单查看答案及解析
-
下列分散系中的分散质能透过滤纸,但不能透过半透膜的是
A.生理盐水 B.Fe(OH)3胶体 C.CuSO4溶液 D.AgI悬浊液
难度: 简单查看答案及解析
-
下列除杂(括号内为杂质)选用的试剂或方法正确的是
A.FeCl2(FeCl3):加入足量铜粉
B.NaCl(Na2CO3):加过量BaCl2溶液后过滤
C.NO2(NO):通过盛有蒸馏水的洗气瓶
D.CO2(HCl):通过盛有饱和NaHCO3溶液的洗气瓶
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,22g CO2含氧原子的数目为NA
B.2mol SO2与2mol O2充分反应后,容器内气体分子数为3NA
C.1mol·L-1的碳酸钠溶液中含Na+的数目为2NA
D.一定条件下,56g铁与足量氯气反应转移的电子数为2NA
难度: 简单查看答案及解析
-
实验室分离、提纯含有不溶性杂质的无水硫酸铜,下列实验操作错误的是
A.
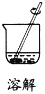 B.
B.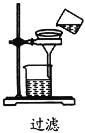 C.
C.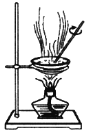 D.
D.
难度: 简单查看答案及解析
-
下列物质有关用途与性质的对应关系错误的是
物质
用途
性质
A
小苏打
用于焙制糕点
小苏打能与碱反应
B
金属钠
用于冶炼钛、锆等金属
金属钠有强还原性
C
二氧化硫
常用于漂白秸秆、织物
SO2能跟其中的有色物质结合
D
浓硫酸
实验室干燥气体
浓硫酸具有吸水性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
实验室配制450mL 1.0mol·L-1 NaOH溶液,下列说法正确的是
A.用托盘天平称取18.0g NaOH固体
B.在烧杯中溶解NaOH固体后立即转移至容量瓶
C.定容时,改用胶头滴管加水至凹液面最低点与刻度线相切
D.NaOH固体在烧杯中称量时间过长,所配NaOH溶液浓度偏高
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A.K+、NH4+、SO42-、OH- B.Na+、H+、HCO3-、NO3-
C.Na+、Ca2+、NO3-、ClO- D.H+、K+、NO3-、SO32-
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是
A.Cl2与H2O反应:
B.用稀盐酸与碳酸钙反应制取
C.过氧化钠与水反应:
D.铜和浓硝酸反应:
难度: 简单查看答案及解析
-
氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是
A.过程I中发生的化学反应属于氧化还原反应
B.过程Ⅱ中
,每转化
转移的电子数为6NA
C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂
D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况)
难度: 简单查看答案及解析
-
如图是硫元素价态与含硫元素物质类别的二维坐标图,其中b、c、d、e分子中只含有一个S原子,下列说法错误的是
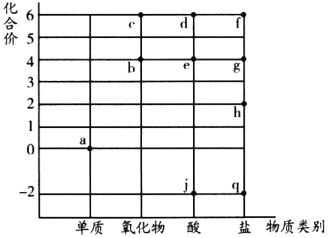
A.物质j和物质e反应生成物质a B.物质b既有氧化性又有还原性
C.物质d的浓溶液具有脱水性 D.物质f可以与物质q发生氧化还原反应
难度: 简单查看答案及解析