-
钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1) 写出As的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3) Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
(4) 砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。

难度: 困难查看答案及解析
-
铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
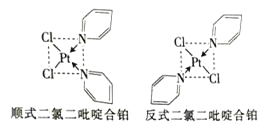
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体
如图
。科学研究表明,顺式分子具有抗癌活性。
①吡啶分子是大体积平面配体,结构简式如图所示。吡啶分子中N原子的杂化方式是____,分子中的大π键可用符号
表示,其中m表示参与形成大π键的原子个数,n表示参与形成大π键的电子个数。则吡啶中的大π键应表示为_____。
②二氯二吡啶合铂分子中所含的C、N、Cl三种元素的第一电离能由大到小的顺序是_____。
③二氯二吡啶合铂分子中存在的微粒间作用力有_________
填字母
。
离子键
配位键
金属键
非极性键
氢键
极性键
④反式二氯二吡啶合铂分子是_________
填“极性分子”或“非极性分子”
。
⑤二氯二吡啶合铂分子是平面结构,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3,简述理由______________。
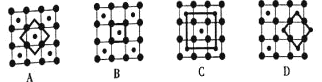
(3)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构
如图所示,小球表示Co原子,大球表示O原子
。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是__________
填字母
。
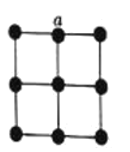
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为d g∙cm-3,则晶胞参数a=_________nm(列计算式)。
难度: 中等查看答案及解析
-
金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为______________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
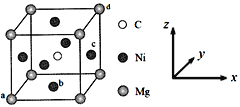
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。
难度: 中等查看答案及解析
-
2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
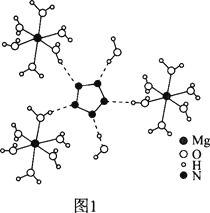
、O、Mg元素的前3级电离能如下表所示:
元素
I1/kJ∙mol-1
I2/kJ∙mol-1
I3/kJ∙mol-1
X
737.7
1450.7
7732.7
Y
1313.9
3388.3
5300.5
Z
1402.3
2856.0
4578.1
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号
表示,其中m代表参与形成大
键的原子数,n代表参与形成大
键的电子数
如苯分子中的大
键可表示为
,则N4-中的大
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
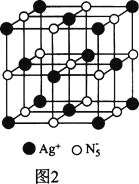
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________g∙cm-3用含a、NA的代数式表示
。
难度: 中等查看答案及解析
-
C、N和Si能形成多种高硬度材料,如
、
、SiC
(1)
和
中硬度较高的是______,理由是______。
(2)
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)
和N能形成一种五元环状有机物咪唑
简写为
,其结构为

化合物
的结构示意图如图2:
①阳离子
和
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
例如水中氢键的表示式为

②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
键”,如
分子中存在“离域
键”
,则im分子中存在的“离域
键”是______。
(4)
为立方晶系晶体,该晶胞中原子的坐标参数为
C:
;
;
0,
,
;
;
Si:
;
;
;
则
立方晶胞中含有______个Si原子、______个C原子。
难度: 困难查看答案及解析
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1)
的名称是三硝酸六尿素合铁
Ⅲ
,是一种重要的配合物.该化合物中
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
碳原子为____杂化,
的空间构型为_____.
(2)尿素分子中
键
键的数目之比_____.
(3)目前发现的铝原子簇
的性质与卤素相似,则原子簇
属于____晶体.
存在的化学键有_____
填字母
.
A.离子键
极性键
非极性键
配位键
氢键
金属键
(4)已知:
 ,反应后,
,反应后,键_____,
键_____
填“增加”或“减少”
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
键”,如
分子中存在“离域
键”,可表示成
,则
咪唑
中的“离域
键”可表示为_________
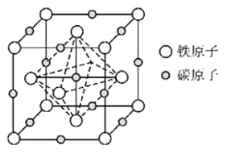
(6)奥氏体是碳溶解在
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
,则晶胞中最近的两个碳原子之间的距离为______
阿伏加德罗常数的值用
表示,写出简化后的计算式即可
.
难度: 困难查看答案及解析
-
有一含Ni的单核六配位配合物,其阳离子空间结构为八面体。1mol该配合物的稀水溶液与足量
混合生成
沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为
。
(1)请画出Ni的价电子排布图:______________________,H、N、O的电负性由大到小的顺序为______________________。
(2)滤液与硝酸银溶液混合不生成沉淀的原因是___________________________________。
(3)该配合物阴离子的中心原子杂化方式为____________,请写出该配合物的化学式:________________。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域
键”。下列微粒中存在“离域
键”的是_________
填序号
。
A.
苯
(5)如图是六方NiAs晶胞的晶胞图及坐标参数,其中
,
,
。晶胞顶点、棱上小球为Ni,As在体内。
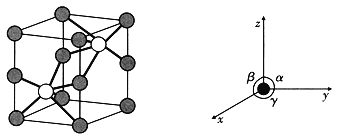
①写出As的配位数为_________,Ni的配位数为_________。
②已知晶胞参数为
,
,则晶胞的密度为____________
写表达式
。
难度: 困难查看答案及解析
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:
反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
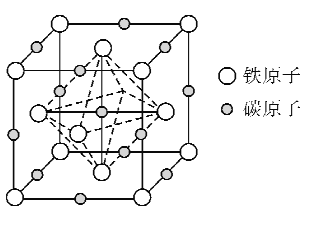
难度: 中等查看答案及解析
-
我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了单壁碳纳米管结构的可控制备难题。海底金属软泥是在海底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为__________。
(2)纳米结构氧化钴可在室温下将甲硫醛(CH2S)完全催化氧化,甲醛分子属__________(填“极性”或“非极性”)分子,其中心原子的VSEPR构型为__________。
(3)六羰基钨[W(CO)6]的熔点为172℃,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的电负性由大到小的顺序为 __________(用元素符号表示)。配体CO中与W形成配位键的原子是C而不是O,原因是 ____________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是 ____________(填字母)。
A.苯 B.二氧化硫 C.四氯化碳 D.环己烷
(5) Fe2+、Fe3+能与CN-形成络离子,其晶胞结构如图1所示。该离子可形成铁蓝钾盐,该钾盐的化学式为___________。

(6)图2是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体是不是Fe3O4的晶胞__________(填“是”或“否”);立方体中铁离子处于氧离子围成的 _________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为 ________g∙cm-3。(图中a=0.42nm,计算结果保留两位有效数字)
难度: 中等查看答案及解析
