-
2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
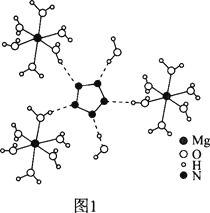
 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
| 元素 | I1/kJ∙mol-1 | I2/kJ∙mol-1 | I3/kJ∙mol-1 |
| X | 737.7 | 1450.7 | 7732.7 |
| Y | 1313.9 | 3388.3 | 5300.5 |
| Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如苯分子中的大
如苯分子中的大 键可表示为
键可表示为 ,则N4-中的大
,则N4-中的大 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
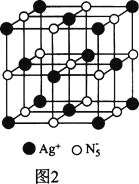
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________g∙cm-3用含a、NA的代数式表示 。
。
-
【化学-选修3:物质结构与性质】
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
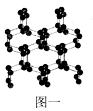
(1)N、O、F三种元素的第一电离能由大到小的顺序为____(填元素符号);与N2互为等电子体的全氧离子化学式为_______;具有空间网状结构的高聚氮结构如图一所示,则N70的沸点_____(填“>”、“<”或“=”)高聚氮的沸点,原因是_________________;N70和高聚氮属于_____(选填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3) 等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是____,SO42-的立体构型为___________。
(3)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO2
B. N2H4分子中N原子均采取sp3杂化
C. NaN3的晶格能小于KN3的晶格能
D.上述生成氢叠氮酸的化学方程式为N2H4+HNO2=2H2O+HN3
(4)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,则阳离子的电子式为_______。
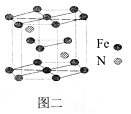
(5)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3, 用NA表示阿伏加德罗常数的值,则该晶体的密度为______。
-
2017年1月27日,南京理工大学胡炳成教授团队成功合成世界上首个全氮阴离子盐,这使我国在高储能材料研制上达到世界先进水平。
(1)基态氮原子核外两种不同自旋状态的电子数之比为________________。
(2)氮的单质除了N2外,还有N4、N6、N8等,现有两种结构的N4分子A和B,A的分子结构与白磷相似,其分子构型为________________;B分子中4个氮原子在同一平面上,氮原子的杂化方式为________________。
(3)全氮阴离子最先制得的是N3-,写出与N3-互为等电子体的两种分子的化学式________________。
(4)试从物质结构与性质的角度解释全氮化合物爆炸时可释放巨大能量的主要原因________________。
(5)全氮阴离子N5-为平面正五边形,称为五唑氮离子,每个N5-离子内有___个π电子,五唑氮的钠盐、钾盐很不稳定。胡教授团队合成的盐为(H3O)4(NH4)2(N5)5Cl,这种盐分解温度高达116.8℃。该盐热稳定性好的主要原因是________________。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为___________。六方氮化硼在高温高压下,可以转化为立方氮化硼。立方氮化硼的结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是______g/cm3(只要求列算式)。
-
2009年,美国麻省理工学院的唐纳德·撒多维教授领导的小组研制出一种镁一锑液态金属储能电池。该电池工作温度为700摄氏度,其工作原理如图所示:

该电池所用液体密度不同,在重力作用下分为三层,充放电时中间层熔融盐的组成及浓度不变。下列说法正确的是
A. 该电池放电时,正极反应式为Mg2+-2e-=Mg
B. 该电池放电时,Mg(液)层生成MgCl2,质量变大
C. 该电池充电时,Mg-Sb(液)层中Mg发生氧化反应
D. 该电池充电时,熔融盐中的Cl-进入Mg-Sb(液)层
-
氢叠氨酸(HN3)及其盐(NaN3、NH4N3、CuN3等) 都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)3 (NH4)4Cl。回答问题:
(1) PHAC中“N3”的化合价为_____________,N2F2的电子式为_____________。
(2)汽车安全气囊中NaN3可发生下列反应:
NaN3(s)=Na(s)+ N2(g) △H1
N2(g) △H1
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H2
则反应CuO(s)+2Na(s)= Na2O(s)+ Cu(s) △H=_______(用△H1和△H2表示)
(3) 25℃,将1molNH4N3(s)投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol,则NH4N3的平衡转化率为________,25℃时该反应的平衡常数K=__________。
(4) 氢叠氨酸(HN3)易溶于水,且酸性与醋酸相近。
① HN3在水溶液中的电离方程式为_____________。
② 0.1mol·L-1的HN3溶液与0.1mol·L-1的NaN3等体积混合,混合溶液中各离子浓度有大到小的顺序为_________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)  2CuN3(s)+S2-(aq)的平衡常数K=_______________。
2CuN3(s)+S2-(aq)的平衡常数K=_______________。
-
氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq) 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
-
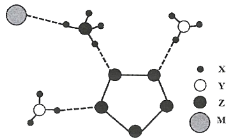
2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
-
2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
-
2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是
A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
-
2018年3月南开大学教授叶萌春及其团队借助廉价金属镍和苯基硼酸共催化的烯基化反应,首次实现烯丙醇高效、绿色合成重大突破。成果也在最新一期《德国应用化学》上发表。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为____。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________。
(6)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中。
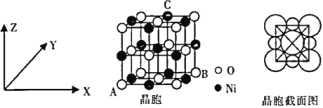
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。

、O、Mg元素的前3级电离能如下表所示:
表示,其中m代表参与形成大
键的原子数,n代表参与形成大
键的电子数
如苯分子中的大
键可表示为
,则N4-中的大
键应表示为________。

。






