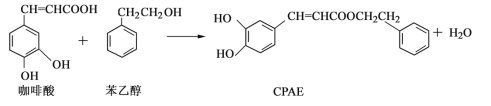
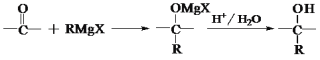
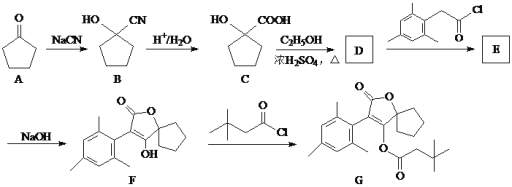
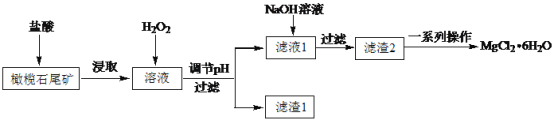
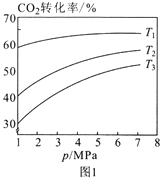
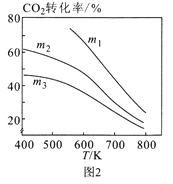
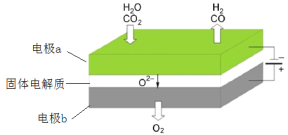
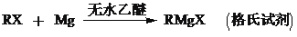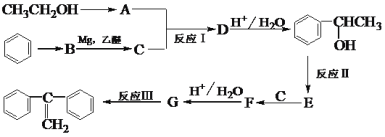-
化学与生产、生活息息相关,下列叙述错误的是
A.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
B.乙烯可作水果的催熟剂
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含重金属离子的电镀废液不能随意排放
难度: 简单查看答案及解析
-
下列有关化学用语表示不正确的是
A.羟基的电子式:
B.对硝基甲苯的结构简式:
C.1-丁烯的键线式:
D.聚丙烯的结构简式:
难度: 简单查看答案及解析
-
下列有机物命名正确的是
A.
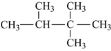 2,3,3﹣三甲基丁烷
2,3,3﹣三甲基丁烷B.
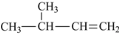 3﹣甲基﹣1﹣丁烯
3﹣甲基﹣1﹣丁烯C.
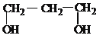 1,3﹣二羟基丙烷
1,3﹣二羟基丙烷D.
苯甲酸
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 L 0.1mol/L NH4Cl溶液中含有NH4+的数目为0.1NA
B.1mol N2(g)和3mol H2(g)混合后充分反应生成的NH3(g)分子数为2NA
C.1 mol
中含有的碳碳双键数为NA
D.标准状况下,2.24 L己烷含有的分子数为0.1NA
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L−1 K2CO3溶液:Na+、Ba2+、ClO− 、OH−
B.0.1 mol·L−1 Al2(SO4)3溶液:Na+、NH4+ 、OH−、Cl−
C.0.1 mol·L−1 HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D.0.1 mol·L−1 NaOH溶液:K+、Na+、SO42−、CO32−
难度: 简单查看答案及解析
-
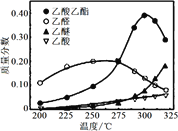
下列方程式书写不正确的是
A.乙酸乙酯的制备:CH3CO18OH + CH3CH2OH
CH3COOCH2CH3 + H218O
B.碳酸的电离方程式:H2CO3
H+ + HCO3−
C.实验室用液溴和苯在催化剂作用下制溴苯:

D.Na2S溶液呈碱性:S2−+ H2O
HS− + OH−
难度: 简单查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
A.
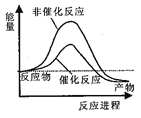 B.
B.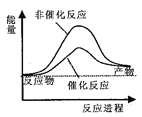
C.
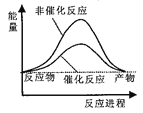 D.
D.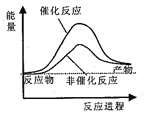
难度: 简单查看答案及解析
-
下列说法不正确的是
A.加入生石灰再蒸馏,可除去乙醇中混有的少量水
B.加入NaOH溶液再振荡静置分液,可除去硝基苯中混有的少量HNO3
C.可以用酸性KMnO4溶液鉴别苯和甲苯
D.加入足量浓溴水充分反应后再过滤,可除去苯中混有的少量苯酚
难度: 简单查看答案及解析
-
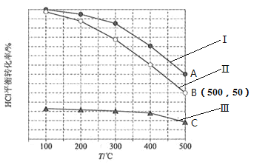
结合下图判断,下列叙述正确的是
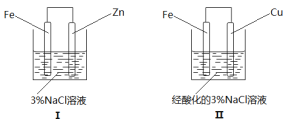
A.I和II中正极材料均未被腐蚀
B.I和II中负极反应均是Fe-2e− = Fe2+
C.I和II中正极反应均是O2+2H2O+4e−=4OH−
D.I和II电解质溶液中的阳离子均向负极作定向移动
难度: 简单查看答案及解析
-
下列关于糖类、油脂、蛋白质的说法不正确的是
A.粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
B.油脂与碱的反应可用来生产肥皂
C.单糖、二糖和油脂都不是高分子化合物
D.将Na2SO4、CuSO4的浓溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
难度: 简单查看答案及解析
-
下列说法正确的是
A.吸热反应N2(g) + O2(g) = 2NO(g) 在高温下可自发进行,则反应的△S>0
B.电解法精炼铜时应将粗铜板作阴极
C.在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的正极相连
D.电镀时应将待镀物品(镀件)与直流电源的正极相连
难度: 简单查看答案及解析
-
用下图所示装置进行实验,其中不合理的是
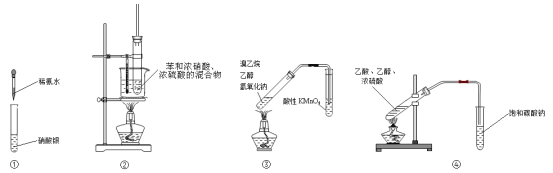
A.用图①装置配制银氨溶液
B.用图②装置制备硝基苯
C.用图③装置检验溴乙烷的消去反应产物中含有乙烯
D.用图④装置制备乙酸乙酯
难度: 简单查看答案及解析