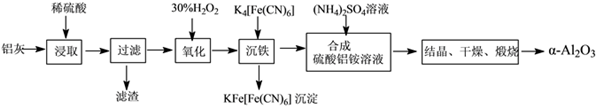-
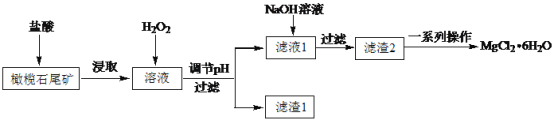
实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____(任写一种)。
(2)滤渣1为Fe(OH)3,则调节pH的范围为____。
(3)“一系列操作”主要包括加入足量盐酸,然后经过蒸发浓缩、冷却结晶、过滤、洗涤,即得到氯化镁晶体。加入足量盐酸的作用为①溶解滤渣2,②____。
(4)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加50 mL蒸馏水使其完全溶解,在不断振荡下,调节pH并加入合适的指示剂,用0.5000 mol/L的EDTA(在方程式中用Y4−表示)标准溶液进行滴定,其反应原理为Mg2++Y4− = MgY2−,滴定达到终点时消耗EDTA标准溶液的体积为19.00 mL。
①计算产品中MgCl2·6H2O的质量分数。____(写出计算过程,结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是____(填字母)。
a.滴定终点时仰视读数
b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出
d.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
-
实验室利用马矿的矿渣(成分Fe2O3、FeO、Al2O3、SiO2)制备明矾[KAl(SO4)2·12H2O]和绿矾FeSO4·7H2O。流程如下:
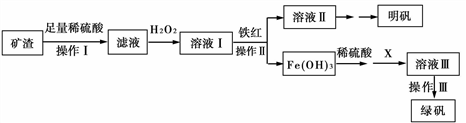
(1)操作I得到的滤渣主要成分是__________。
(2)加入H2O2的离子反应方程式为__________。
(3)若X是一种固体单质,且溶液Ⅲ的溶质只有一种,则X化学式为_________。
(4)向明矾水溶液中加过量的NaOH溶液,其离子方程式为_________。
(5)绿矾放置在空气中,可能被氧气氧化,请设计实验判断绿矾是否被氧化(简述实验过程、现象和结论)____ 。
(6)若实验室取用1kg矿渣(含铁元素5.6%)进行实验,操作Ⅱ中消耗铁红80g,假设每个过程反应都恰好完全进行,且忽略损失,则理论上得到绿矾__________g
-
某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:
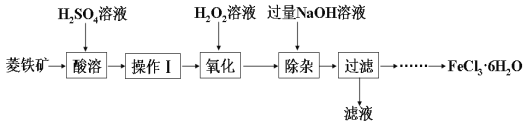
(1)酸溶及后续过程中均需保持酸过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是___________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为___________。
(4)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3−=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4−= Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是___________。 (仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(5)加入过量NaOH溶液的目的是___________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。___________
-
以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
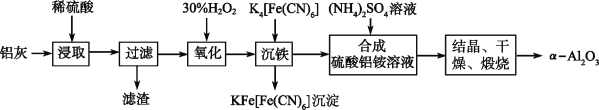
(1)写出铝灰与硫酸反应涉及的离子方程式________________________________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为______________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
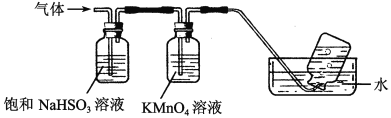
①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO4—被还原为Mn2+),发生的离子反应方程式为_________________。
-
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
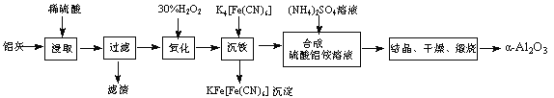
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
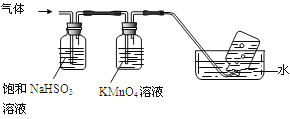
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
-
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
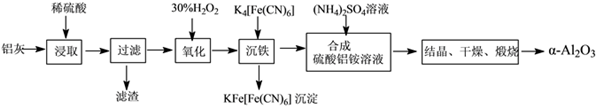
(1)铝灰中氧化铝与硫酸反应的化学方程式为____________________________________。
(2)加30%的H2O2溶液的目的是_________________________________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]  2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体为___________(填化学式)。
②KMnO4溶液褪色(MnO4-还原为Mn2+),此褪色过程中,氧化剂与还原剂的物质的量之比为_______________。
-
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
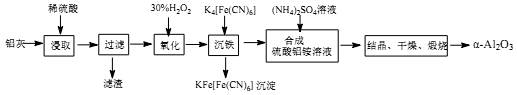
(1)铝灰中氧化铝与硫酸反应的化学方程式为_____________________;
(2)加30%的H2O2溶液的目的是_____________________;
(3)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如下图所示的装置。
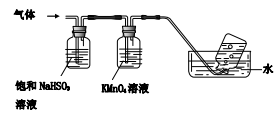
①集气瓶中收集到的气体是________(填化学式);
③KMnO4溶液褪色(MnO4-还原为Mn2+),此褪色过程中,氧化剂与还原剂的物质的量之比为________。
-
以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
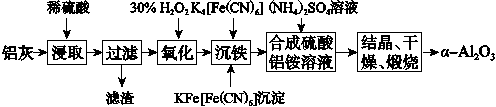
(1)铝灰中氧化铝与硫酸反应的化学方程式为__________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30% H2O2溶液发生反应的离子方程式为_________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生反应的离子方程式为______________。
-
(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)硫铁矿高温焙烧的化学方程式为________; 少量的SO2与NaOH溶液反应的离子方程式为________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和________ ,
题问所涉及反应的离子方程式为________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________ ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为________________________(写化学式)。
-
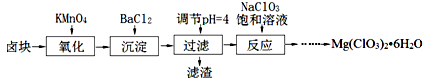
(15分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
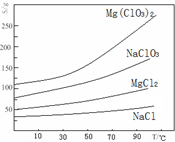
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2•6H2O的质量分数为 。