-
下列有关环境保护与绿色化学的叙述不正确的是
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的污水任意排放造成的
难度: 中等查看答案及解析
-
海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是
A.食盐 B.钠 C.溴 D.碘
难度: 中等查看答案及解析
-
下列常见金属的冶炼原理中不合理的是
金属
冶炼原理
A
Fe
B
Hg
C
Al
D
Mg
难度: 中等查看答案及解析
-
下列化学用语的书写,正确的是
A.氯气的电子式:
B.硫原子的结构示意图:
C.溴化钠的电子式:
D.质量数为37的氯原子 37 17Cl
难度: 中等查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列原子与氢原子形成的共价键中,极性最强的是
A.F B.Cl C.N D.O
难度: 中等查看答案及解析
-
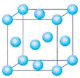
下列有关金属的说法正确的是
A.金属原子的核外电子在金属晶体中都是自由电子
B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6
C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12
D.金属导电的实质是金属阳离子在外电场作用下的定向移动
难度: 中等查看答案及解析
-
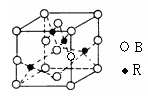
下面有关晶体的叙述中,不正确的是
A.氯化钠晶体中,每个Na+周围紧邻6个Cl-
B.氯化铯晶体中,每个CS+周围紧邻8个Cl-
C.氟化钙晶胞中,每个F-周围紧邻8个Ca2+、每个Ca2+周围紧邻8个F-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
难度: 中等查看答案及解析
-
下列物质中σ键和π键数目比为1 :2的是
A.O2 B. HCN C.CO2 D.N2
难度: 中等查看答案及解析
-
下列各含氧酸中,酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
难度: 中等查看答案及解析
-
下列关于F、Cl、Br、I的比较,说法正确的是
A.原子最外层的电子数随核电荷数的增加而增多
B.简单阴离子的还原性随核电荷数的增加而增强
C.氢化物的稳定性随核电荷数的增加而增强
D.非金属性随核电荷数的增加而增强
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-== BaSO4↓+H2O
B.稀碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- == CO32- + H2O
C.氯化铝溶液中滴加过量氨水:Al3+ + 3NH3·H2O== Al(OH)3↓+ 3NH4+
D.常温下,将铜片加入稀硝酸中:Cu + 2H+ == Cu2+ + 2H2↑
难度: 中等查看答案及解析
-
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
A.由极性键构成的极性分子 B.由非极性键构成的非极性分子
C.由非极性键构成的极性分子 D.由极性键构成的非极性分子
难度: 中等查看答案及解析
-
氯化溴(BrCl)结构和性质类似Br2 、 Cl2。下列叙述正确的是
A. BrCl是离子化合物 B.Br-Cl键长大于Cl-Cl键长
C.BrCl 和Br2中都存在极性键 D.BrCl和 Cl2都是非极性分子
难度: 中等查看答案及解析
-
下列基态原子或离子核外未成对电子数目为5的是
A.Fe3+ B.P C.Cr D.Cu
难度: 中等查看答案及解析
-
下列各组分子中,中心原子杂化轨道的类型不相同的是
A.CO2与SO2 B.CH4与NH3 C.SO3与BF3 D. H2S与CCl4
难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强
难度: 中等查看答案及解析
-
可用下图所示装置制取(必要时可加热)、净化、收集的气体是
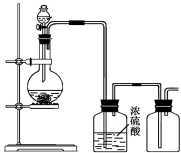
A.铜与稀硝酸反应制一氧化氮
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.亚硫酸钠固体与硫酸反应制二氧化硫
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期主族元素的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子的空间构型可能是正四面体
D.WY2分子中δ键与π键的数目之比是2:1
难度: 中等查看答案及解析
-
将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63%
B.该合金中铜与镁的物质的最之比是2:1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL
难度: 中等查看答案及解析