-
下列人体所必需的元素中,缺乏会导致骨质疏松、佝偻病的是
A. 铁 B. 碘 C. 锌 D. 钙
难度: 简单查看答案及解析
-
近期新型冠状病毒在全球蔓延。过氧乙酸消毒液可有效杀灭新型冠状病毒。过氧乙酸(化学式为C2H4O3)是弱酸性无色液体,溶解性与醋酸相似。下列叙述错误的是
A.过氧乙酸由C、H、O三种元素组成 B.过氧乙酸难溶于水
C.过氧乙酸具有酸性 D.过氧乙酸是一种有机物
难度: 中等查看答案及解析
-
蒸馒头用到纯碱,其化学式为
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
难度: 简单查看答案及解析
-
下列变化中,属于化学变化的是
A.蜡烛燃烧 B.冰雪融化 C.酒精挥发 D.水果榨汁
难度: 简单查看答案及解析
-
下列属于国家节水标志的图标
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列对化学用语中“2”所表示意义的理解,正确的是
A.2Mg中的“2”表示两个镁元素 B.H2中的“2”表示两个氢原子
C.2NH3中的“2”表示2个氨分子 D.Ca2+中的“2”表示钙元素的化合价为+2价
难度: 简单查看答案及解析
-
全球近140个国家根据《国际防治汞污染公约》,在2020年前禁止生产和进出口含汞产品。汞元素在元素周期表中的信息如图所示。下列叙述正确的是
A.汞为非金属元素 B.汞元素的原子序数为80
C.汞原子的中子数是80 D.汞元素的相对原子质量为200.6g
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.石墨具有导电性,可用于制铅笔芯 B.氧气能助燃,可用于医疗急救
C.氢气密度小,可用作清洁能源 D.金刚石硬度大,可用于切割玻璃
难度: 简单查看答案及解析
-
用分子、原子的观点解释下列现象,其中不合理的是
A.水结成冰——0℃分子停止运动 B.电解水生成氢气和氧气——分子发生了变化
C.气体可以压缩——分子间有间隔 D.1g水约有3.01×1023个分子——分子质量很小
难度: 简单查看答案及解析
-
在给定条件下,下列物质间的转化能一步实现的是
A.Fe
FeCl B.CaCl2溶液
CaCO3
C.S
SO3 D.CO
CO2
难度: 简单查看答案及解析
-
下列有关X、Y表示的概念之间存在如图所示的“从属”关系的是
选项
X
Y
A
氧化物
纯净物
B
溶液
乳浊液
C
单质
金属
D
复分解反应
中和反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验操作正确的是
A.
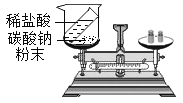 验证质量守恒定律 B.
验证质量守恒定律 B.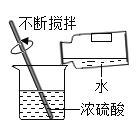 稀释浓硫酸
稀释浓硫酸C.
 闻药品气味 D.
闻药品气味 D.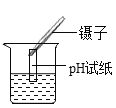 测溶液的pH
测溶液的pH难度: 简单查看答案及解析
-
右图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )
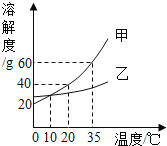
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.10℃时甲、乙两物质的溶解度相等
D.甲中混有少量乙时可用蒸发结晶的方法提纯甲
难度: 简单查看答案及解析
-
向氧化铜和铁粉的混合物中加入一定量稀硫酸,充分搅拌使反应充分,过滤,将所得滤渣加入稀硫酸中,未见滤渣溶解。下列判断正确的是
A.滤渣中一定含铜,可能含铁 B.滤渣中一定含有铜
C.滤液中一定含有硫酸铜 D.滤液中一定没有硫酸
难度: 中等查看答案及解析
-
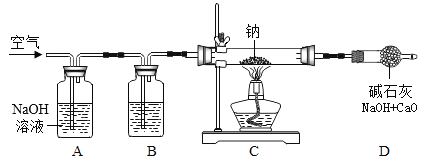
Cux(OH)y(CO3)z是用途广泛的化工原料,受热时其化学反应表达式为:Cux(OH)y(CO3)z
CuO+CO2+H2O(x、 y、z为正整数)。在下图热分解装置中加入44.4 g Cux(OH)y(CO3)z,完全反应后测得装置A增重3.6 g,装置B增重8.8 g(加热前、后均通一段时间N2;装置气密性良好,药品量足,实验操作正确;碱石灰是CaO和NaOH的固体混合物)。下列说法不正确的是( )
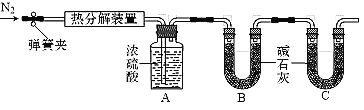
A.2x = y + 2z B.生成的CuO质量为32 g
C.Cux(OH)y(CO3)z为Cu(OH)2CO3 D.x:y =1:1
难度: 困难查看答案及解析