-
向AgNO3和Mg(NO3)2溶液中加入一定量Zn粉和Cu粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是
A. 向滤渣中加入稀盐酸,可能有气泡产生 B. 滤液中一定有Cu(NO3)2、Mg(NO3)2、Zn(NO3)2
C. 滤渣中一定有Ag,可能有Cu和Zn D. 滤液中一定无AgNO3,可能有Zn(NO3)2
难度: 困难查看答案及解析
-
2020年5月12日是我国第12个“防灾减灾日”,了解防灾减灾的相关知识,有利于保护人们的生命、财产安全。下列关于火灾、灭火与逃生的说法错误的是
A.严禁携带易燃、易爆物品乘坐火车
B.加油站、面粉加工厂、煤矿的矿井内都应严禁烟火
C.遇火灾,如果火势较大,立即按打119电话报警
D.生活中常用水来灭火,其原理是降低可燃物的着火点
难度: 简单查看答案及解析
-
最适合作清洁燃料的是( )
A. 氢气 B. 汽油 C. 柴油 D. 煤
难度: 简单查看答案及解析
-
垃圾分类可以减少污染,节约资源。下列图示表示某塑料包装制品回收标志的是( )
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列变化属于化学变化的是( )
A. 过滤粗食盐水 B. 电解水
C. 活性炭净化水 D. 海水晒盐
难度: 简单查看答案及解析
-
实验是学习化学的重要手段。以下做法正确的是( )
A. 将含有酸性物质的废液直接倒入下水道
B. 将pH试纸伸入待测液中测定溶液的酸碱度
C. 做铁丝在氧气中燃烧的实验时,集气瓶内预留少量的水
D. 稀释浓硫酸时,将水沿器壁慢慢注入盛有浓硫酸的烧杯中
难度: 中等查看答案及解析
-
下列化学用语所表达的意义正确的是
A.2He--2个氦元素
B.2H2--2个氢分子
C.C60--60个碳原子
D.Zn2+--正二价的锌元素
难度: 简单查看答案及解析
-
钪(Sc)是一种“工业的维生素”。下图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是
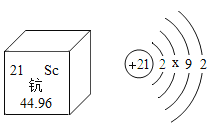
A.钪属于非金属元素
B.钪的相对原子质量是44.96g
C.原子结构示意图中x=10
D.钪原子中的核外电子数是21
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.浓硫酸有吸水性,可用作干燥剂
B.二氧化碳能溶于水,可用作灭火剂
C.氢氧化钠呈碱性,可用于改良酸性土壤
D.浓盐酸具有挥发性,可用于金属表面除锈
难度: 简单查看答案及解析
-
科学家成功合成新型催化剂,能将CO2高效转化为甲醇(CH3OH),该化学反应的微观过程如下图所示。下列说法正确的是
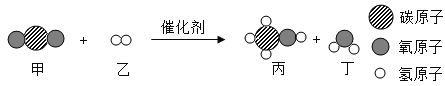
A.甲分子与丁分子的化学性质不同
B.甲醇分子中碳、氢原子个数比为1∶3
C.参加反应的甲、乙物质的质量比为22∶1
D.反应前后,原子的种类没有改变,个数改变
难度: 中等查看答案及解析
-
在给定条件下,下列物质间的转化能一步实现的是
A.H2O2
O2
SO3
B.CO
Fe
FeCl3
C.CuO
CuCl2
Cu(OH)2
D.Na2CO3
Na2SO4
NaCl
难度: 中等查看答案及解析
-
化学概念之间在逻辑上存在并列、交叉和包含等关系。下列各图中概念之间关系正确的是
A.
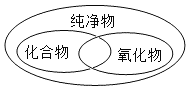 B.
B.
C.
 D.
D.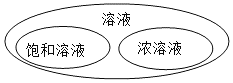
难度: 简单查看答案及解析
-
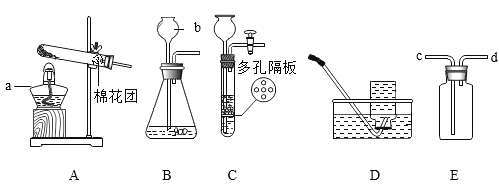
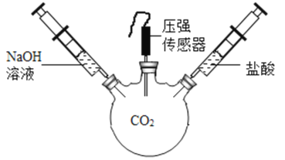
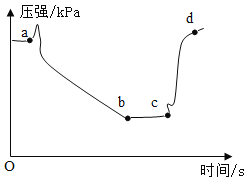
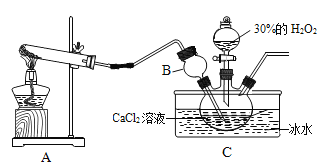
下列实验能达到实验目的的是
A.
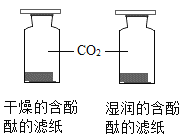 装置探究CO2与水发生反应
装置探究CO2与水发生反应B.
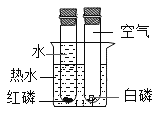 装置探究空气是燃烧的必要条件
装置探究空气是燃烧的必要条件C.
装置探究温度对分子运动快慢的影响
D.
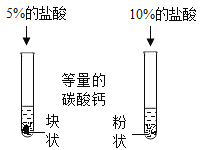 装置探究接触面积对反应速率的影响
装置探究接触面积对反应速率的影响难度: 中等查看答案及解析
-
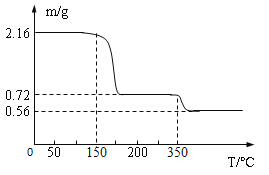
T1℃时,将等质量的KNO3、KCl分别加入到各盛有100g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图所示。下列说法不正确的是
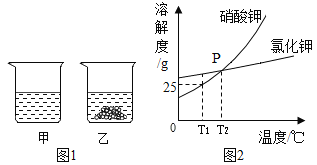
A.甲中加入的固体是KCl
B.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
C.甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液
D.若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数相等
难度: 中等查看答案及解析
-
现有含一定量氯化钠的纯碱样品,测得其中钠元素的质量为6.9g,向该样品中加入溶质质量分数为10%的稀盐酸73g,恰好完全反应。则原固体混合物中氯化钠的质量为
A.5.85 B.10.6g C.1.7 D.17.55g
难度: 困难查看答案及解析