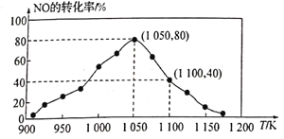
-
下列各项表述正确的是
A.丙烯的键线式:
B.CH2F2的电子式:
C.醛基官能团符号: CHO— D.一个硝基(-NO2)和一个二氧化氮分子(NO2)的电子数相等
难度: 简单查看答案及解析
-
图分别是A、B两种物质的核磁共振氢谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的核磁共振氢谱推测A、B有可能是下面的
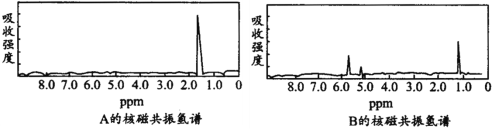
A.C3H6,C6H6 B.C2H6,C3H6 C.C6H6 ,C2H6 D.C3H6,C2H6
难度: 简单查看答案及解析
-
下列说法正确的是
A.pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
B.放热反应的反应速率总是大于吸热反应的反应速率
C.pH=2的盐酸与pH=2醋酸溶液中氢离子数相等
D.常温,0.01mol/L的NaHSO4溶液与pH=12的氨水等体积混合后溶液呈碱性
难度: 简单查看答案及解析
-
下列有关离子水解的方程式中正确的是。
A.NH4Cl溶液在重水(D2O)中水解:NH4++D2O
NH3•HDO+D+
B.
溶液:
HPO42-+H3O+
C.
溶液:
H2CO3+2OH-
D.
溶液:
=Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
下列说法正确的是
A.在25℃、101KPa,1molS(s)和2molS(s)的燃烧热相等
B.1molH2SO4(浓)与1molBa(OH)2完全中和所放出等于中和热的数值
C.同温同压下,H2(g)+Cl2(g)
2HCl(g)在光照和点燃条件下的△H不同
D.图中的反应:逆反应的活化能小于正反应的活化能,由图可知催化剂可以改变反应的△H
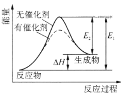
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.FeCl3+3KSCN
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B.工业合成氨中,将氨气液化分离
C.对2HI
H2(g)+I2(g)平衡体系加压,颜色迅速变深
D.NO2气体被压缩后,颜色先变深后变浅
难度: 简单查看答案及解析
-
某苯的同系物分子式为C11H16,经测定数据表明,分子中除苯环外不再含其他环状结构,分子中还含有两个—CH3,两个—CH2—和一个
,则该分子由碳链异构体所形成的同分异构体有( )
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
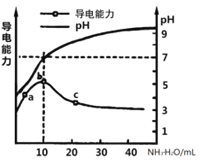
A.a~b点导电能力增强说明HR为弱酸
B.a、b点所示溶液中水的电离程度不相同
C.b恰好完全中和,pH=7说明NH4R没有水解
D.c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
难度: 中等查看答案及解析
-
常温下,用AgNO3溶液分别滴定浓度均为0.01 mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
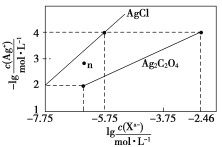
A.Ksp(Ag2C2O4)的数量级等于10-11
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04
难度: 中等查看答案及解析
-
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是
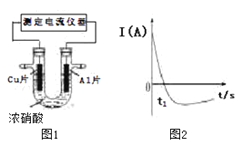
A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
难度: 困难查看答案及解析
-
《科学美国人》评出的2016年十大创新科技之一的碳呼吸电池,电池原理如下图所示,已知草酸铝[Al2(C2O4)3]难溶于水,则下列说法正确的是
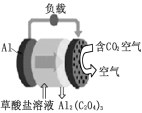
A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e- =2CO2
C. 每生成 1 mol Al2(C2O4)3,有 6 mol 电子流过负载
D. 随着反应的进行草酸盐浓度不断减小
难度: 中等查看答案及解析
-
H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是
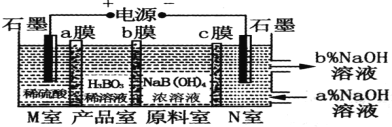
A.M室发生的电极反应式为:2H2O-4e- =O2↑+4H+
B.N室中:a%<b%
C.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D.理论上每生成1mol产品,阴极室可生成标准状况下5.6 L气体
难度: 困难查看答案及解析
-
四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是
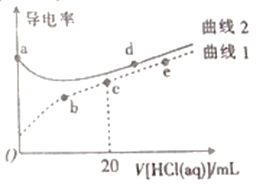
A.在a、b、c、d、e中,水电离程度最大的点是d
B.c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C.曲线I中c与e之间某点溶液呈中性
D.a点溶液pH=12
难度: 中等查看答案及解析
-
室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
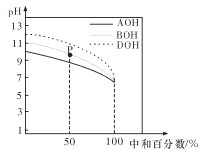
A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
难度: 困难查看答案及解析
-
常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )
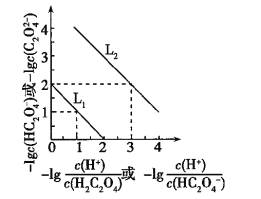
A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
难度: 困难查看答案及解析