-
关于氧气和二氧化碳的说法正确的是
A. 构成:都是由分子构成,且都含有氧分子
B. 性质:常温下均为气体,且都易溶于水
C. 用途:氧气可用作燃料,二氧化碳可用作化工原料
D. 转化:在自然界中氧气和二氧化碳可以相互转化
难度: 中等查看答案及解析
-
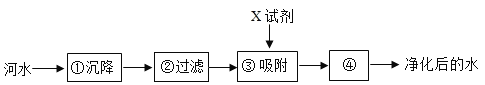
2019年中国水周的主题为“坚持节水优先,强化水资源管理”。下列有关水的认识正确的是( )
A. 生活中常用煮沸的方法降低水的硬度
B. 过滤可以除去水中所有的杂质
C. 电解水实验说明水由氢气和氧气组成
D. 农业上大水漫灌农作物
难度: 简单查看答案及解析
-
“绿水青山就是金山银山”,垃圾分类处理有利于生态文明建设。废弃物中,易拉罐属于
A. 可回收物 B. 餐厨垃圾 C. 有害垃圾 D. 其它垃圾
难度: 简单查看答案及解析
-
“一带一路”是我国新时代经济发展的重要战略。下列技术中不属于化学变化的是( )
A.蚕丝织布 B.谷物酿酒 C.烧制瓷器 D.冶炼青铜
难度: 简单查看答案及解析
-
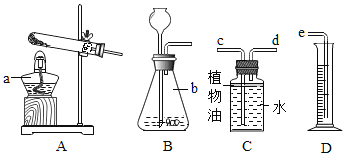
下列图示实验操作中,正确的是
A.
B.
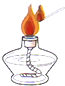
C.
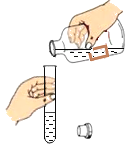 D.
D. 难度: 简单查看答案及解析
-
下列物质由分子构成的是( )
A.金刚石 B.铁 C.氯化钠 D.氧气
难度: 简单查看答案及解析
-
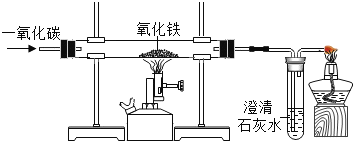
下列四支试管中,铁钉锈蚀最快的是( )
A.
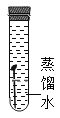 B.
B. C.
D.
难度: 简单查看答案及解析
-
每年三月的最后一个星期一是全国中小学安全教育日。下列说法错误( )
A.煤矿的矿井要加强通风,防止发生爆炸
B.炒菜时油锅着火,立即盖上锅盖灭火
C.厨房天然气泄露,可打开抽油烟机排气
D.进入久未开启的地窖,要做灯火实验
难度: 简单查看答案及解析
-
某种药物的化学式为C6H9O6N,下列有关该药物的说法错误的是
A. 由四种元素组成 B. 相对分子质量为191
C. 1个分子由22个原子构成 D. 碳、氧两种元素的质量比为1:1
难度: 简单查看答案及解析
-
如图是利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。点燃红磷,待红磷熄灭并冷却后,打开止水夹。瓶内气压的变化如图。下列说法不正确的是
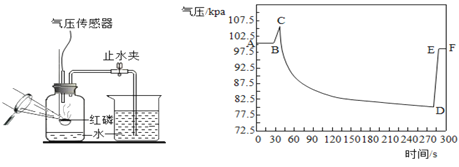
A.AB段气压不变是红磷没有开始燃烧
B.BC段气压增大是因为燃烧放热
C.CD段气压减小是因为集气瓶内氧气不断被消耗
D.DE段气压增大是因为烧杯中水进入集气瓶后,气体体积增大
难度: 中等查看答案及解析