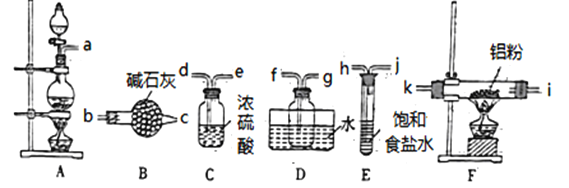
-
中国诗词深受众人喜爱,针对下列一些诗词,从化学角度解读正确的是
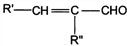
A.王安石的《梅花》 “遥知不是雪,唯有暗香来”描述了物质发生化学变化过程中既有状态变化又有气味的产生
B.庾信的《杨柳歌》“独忆飞絮鹅毛下,非复青丝马尾垂”从化学成分分析现实生活中“飞絮”“鹅毛”主要成分都是蛋白质
C.赵孟頫的《烟火诗》“纷纷灿烂如星陨,赫赫喧虺似火攻”描述了颜色反应的现象
D.刘禹锡的《浪淘沙》“千淘万漉虽辛苦,吹尽狂沙始到金”,说明金在自然界中以游离态存在,其化学性质稳定
难度: 中等查看答案及解析
-
阿伏加德罗是意大利化学家(1776.08.09- 1856.07.09),曾开业当律师,24岁后弃法从理,十分勤奋,终成一代化学大师。为了纪念他,人们把1 mol某种微粒集合体所含有的粒子个数,称为阿伏加德罗常数,用N
表示。下列说法或表示中不正确的是

A.科学上规定含有阿伏加德罗常数个粒子的任何微粒集合体都为1 mol
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
C.60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2
D.6.02×1023mol-1 叫做阿伏加德罗常数
难度: 中等查看答案及解析
-
已知一组有机物的分子式通式,按某种规律排列成下表
项序
1
2
3
4
5
6
7
……
通式
C2H4
C2H4O
C2H4O2
C3H6
C3H6O
C3H6O2
C4H8
……
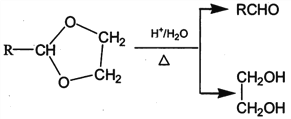
各项物质均存在数量不等的同分异构体。其中第12项的异构体中,属于酯类的有(不考虑立体异构)
A.8种 B.9种 C.多于9种 D.7 种
难度: 困难查看答案及解析
-
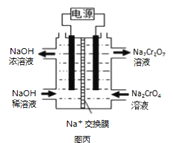
X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
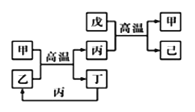
A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
难度: 中等查看答案及解析
-
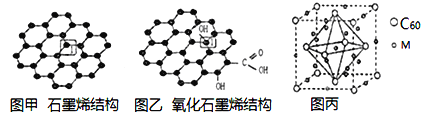
下列有关实验操作对应的现象及结论都正确且二者存在因果关系的是
选项
实验
现象
结论
A
向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液
观察、对比气体产生的速度
可比较CuSO4和KMnO4的对H2O2分解的催化效果
B
向植物油和矿物油中分别加入烧碱溶液,加热
冷却后观察到其一分层,另一不分层
分层的是矿物油,不分层的是植物油
C
将浓硫酸滴到胆矾晶体表面
晶体表面出现黑斑
浓硫酸具有脱水性
D
SO2通入Ba(NO3)2溶液
产生白色沉淀
SO2与可溶性钡盐均可生成白色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于金属腐蚀和保护的说法正确的是
A.牺牲阳极的阴极保护法利用电解法原理
B.金属的化学腐蚀的实质是:M-ne-=Mn+,电子直接转移给还原剂
C.外加直流电源的阴极保护法,在通电时被保护的金属表面腐蚀电流降至零或接近于零。
D.铜碳合金铸成的铜像在酸雨中发生电化学腐蚀时正极的电极反应为:2H++2e-=H2↑
难度: 中等查看答案及解析
-
常温下,H2A和H2NCH2CH2NH2溶液中各组分的物质的量分数δ随pH的变化如图(I)、(II)所示。下列说法不正确的是已知:
。
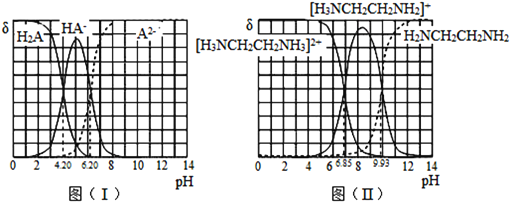
A.NaHA溶液中各离子浓度大小关系为:
B.乙二胺(H2NCH2CH2NH2)的Kb2=10-7.15
C.[H3NCH2CH2NH3]A溶液显碱性
D.向[H3NCH2CH2NH2] HA溶液中通人HCl,
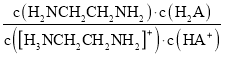 不变
不变难度: 困难查看答案及解析
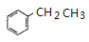 +HBr。
+HBr。