-
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:
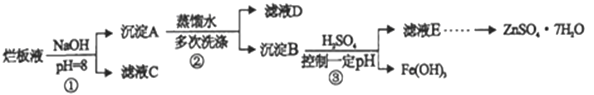
(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是 _________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________(填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____(填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s)  Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l)  H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________。(用含Ksp、Kw的代数式表示)
-
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:
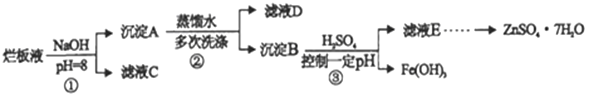
(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是 _________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________(填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____(填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s)  Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l)  H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________。(用含Ksp、Kw的代数式表示)
-
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
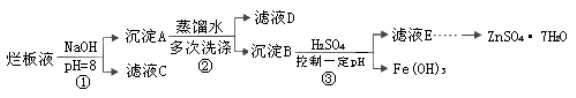
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH= a kJ•mol-1
Fe3+(aq)+3OH-(aq) ; ΔH= a kJ•mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH= b kJ•mol-1
H+(aq)+OH-(aq) ;ΔH= b kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
-
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
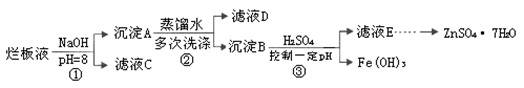
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是________。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式________。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有________(填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是________(填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是:________ 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH= a kJ•mol-1
Fe3+(aq)+3OH-(aq) ; ΔH= a kJ•mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH= b kJ•mol-1
H+(aq)+OH-(aq) ;ΔH= b kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式:________ 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K=________。(用含KSP、KW的代数式表示)
-
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
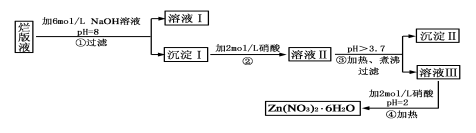
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
-
能正确表示下列反应的离子方程式的是( )
A. 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
C. 向明矾溶液中加入过量氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D. 等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3—+Ca2++2OH—=CaCO3↓+CO32—+2H2O
-
能正确表示下列反应的离子方程式是( )
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气跟水反应:Cl2+H2O⇌H++Cl-+HClO
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO-3═2H2O+NO
D.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
-
能正确表示下列反应的离子方程式的是( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
C.向明矾溶液中加入过量氢氧化钡溶液:
Al3++2SO2-4+2Ba2++4OH-=2BaSO4↓+AlO-2+2H2O
D.等物质的量的NaHCO3和Ca(OH)2溶液混合:
2HCO3—+Ca2++2OH—=CaCO3↓+CO32—+2H2O
-
在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是
A.向废液中加入少量的葡萄糖溶液,无红色沉淀产生,说明废液中不含Cu2+
B.向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl-
C.向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+
D.向废液中滴加KSCN溶液,无现象,再加入氯水后溶呈血红色,说明废液中含有Fe2+
-
“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子.在实验室中由“烂板液”制取ZnSO4•7H2O的过程如下:
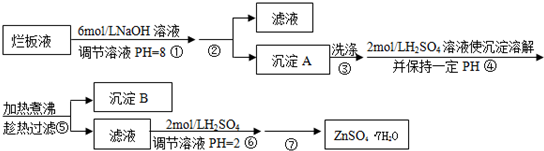
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 6.4 | 8.0 |
(1)第①反应是使Zn2+、Fe3+沉淀,检验Fe3+是否沉淀完全的操作是________.
(2)第②步操作中需要的玻璃仪器有________.
(3)第④步中PH应保持在________.
(4)第⑥步调节溶液PH=2的目的是________.
(5)操作⑦包含3个基本实验操作,它们是________、________和过滤.

Fe3+(aq)+3OH-(aq) △H=a kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol




