-
25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A. c(SO42-)>c(NH4+)>c(H+)=c(OH-) B. c(NH4+)=2c(SO42-)
C. c(NH4+)+c(NH3·H2O)=2c(SO42-) D. c(OH-)+c(SO42-)=c(H+)+c(NH4+)
难度: 简单查看答案及解析
-
化学与社会、生产、生活密切相关,下列说法不正确的是
A.焊接金属时常用NH4Cl溶液做除锈剂
B.海水淡化可以解决淡水危机,用光催化分解代替电解水制氢气可实现节能环保
C.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
D.天然气、沼气和太阳能分别属于化石能源、可再生能源和二次能源
难度: 简单查看答案及解析
-
一定条件下,将10 mol H2和1 mol N2充入一密闭容器中,发生反应:N2(g)+3H2(g)
2NH3(g),达到平衡时,H2的转化率可能是
A. 25% B. 30% C. 35% D. 75%
难度: 简单查看答案及解析
-
已知25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则热化学方程式正确的是
A.C(s)+
O2(g)=CO(g) △H=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-890.3kJ/mol
D.
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) △H=-1400kJ/mol
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.由水电离的c(OH-)=10-13 mol·L-1的溶液中:K+、Na+、CH3COO-、NO3-
B.由水电离的c(OH-)·c(H+)=10-20 mol2·L-2的溶液中:Na+、K+、NO3-、SO42-
C.Kw/c(H+)=l×10-13 mol/L的溶液中:Ba2+、ClO-、Cl-、NO3-
D.溶液中c(H+)/c(OH-)=l×10-12 的溶液:CH3COO-、NO3-、NH4+、SO42-
难度: 中等查看答案及解析
-
下图为H2与O2反应生成H2O(g)的能量变化示意图,下列有关叙述不正确的是
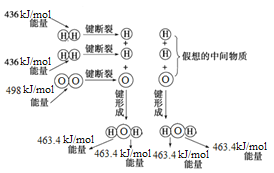
A.1 mol H2分子断键需要吸收436 kJ的能量
B.H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C.反应物的总能量高于生成物的总能量
D.形成化学键释放的总能量比断裂化学键吸收的总能量小
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.红棕色的NO2加压后颜色先变深后变浅 B.温度过高对合成氨不利
C.钢铁在潮湿的空气中容易生锈 D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
难度: 中等查看答案及解析
-
被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O
2MnO(OH)+2OH-
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
难度: 中等查看答案及解析
-
常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.将100 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到100 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.0.1 mol·L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
D.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
难度: 中等查看答案及解析
-
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A.MnS的溶解度比CuS的溶解度大
B.该反应达到平衡时,c(Cu2+)=c(Mn2+)
C.向上述平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应平衡常数K=
难度: 中等查看答案及解析
-
某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g)⇌ 2Z(g)。反应过程中测定的部分数据如下表:
t/min
n(X)/mol
n(Y)/mol
0
1.20
0.60
1
0.90
2
0.80
4
0.20
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小
难度: 中等查看答案及解析
-
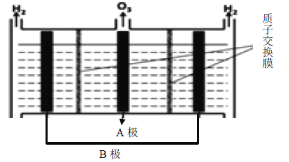
现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是
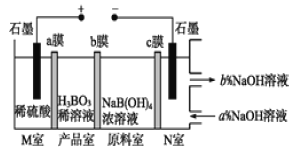
A.M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B.产品室发生的反应是:B(OH)4-+H+
H3BO3+H2O
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.b膜为阴离子交换膜
难度: 中等查看答案及解析
-
在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
难度: 简单查看答案及解析
-
向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法正确的是
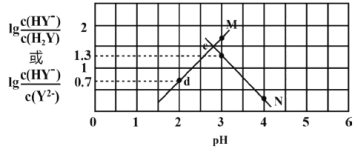
A.曲线N表示pH与
的变化关系
B.交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
C.d点溶液中:c(H+)-c(OH-)=c(Y2-)+c(HY-)-c(K+)
D.Ka2(H2Y)=10-4.3
难度: 中等查看答案及解析