-
在A(g)+B(g)=C(g)+2D(g)反应中,下列表示的反应速率最快的是
A.υ(A)=0.1mol• L-1 • min-1 B.υ(B)= 0.2mol• L-1 • min-1
C.υ(C)= 0.3mol• L-1 • min-1 D.υ(D)= 0.4mol• L-1 • min-1
难度: 简单查看答案及解析
-
在一定条件下发生如下反应:COCl2(g)
CO(g)+Cl2(g) △H<0下列有关说法正确的是
A.单位时间内生成CO和Cl2的物质的量比为1∶1时,反应达到平衡状态
B.用催化剂能提高反应物的平衡转化率
C.平衡时其他条件不变,升高温度能提高COCl2的转化率
D.当反应达平衡时,恒温恒压条件下通入Ar能提高COCl2的转化率
难度: 中等查看答案及解析
-
对于反应C(s)+H2O(g)
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小 D.增加C(s)的量,平衡正向移动
难度: 中等查看答案及解析
-
已知:①H2O(g)=H2O(l)△H1=﹣a kJ•mol﹣1
②C2H5OH(g)=C2H5OH(l)△H2=﹣b kJ•mol﹣1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=﹣c kJ•mol﹣1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为
A.(b﹣a﹣c)kJ B.(3a﹣b +c )kJ C.(a﹣3b+c)kJ D.(b﹣3a﹣c)kJ
难度: 中等查看答案及解析
-
下列说法错误的是
A.决定化学反应速率的主要因素是参加反应的物质的性质
B.升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小
C.对于有气体参加的反应,增大压强,反应速率加快
D.催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率
难度: 简单查看答案及解析
-
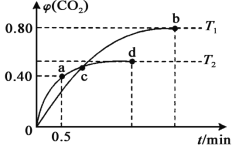
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
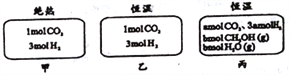
A.刚开始反应时速率:甲>乙 B.平衡后反应放热:甲>乙
C.500℃下该反应平衡常数:K=3×102 D.若a≠0,则0.9<b<l
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.任何反应都伴有能量的变化
B.化学反应中的能量变化可表现为热量的变化
C.反应物的总能量低于生成物的总能量时,发生吸热反应
D.反应物的总能量高于生成物的总能量时,发生吸热反应
难度: 简单查看答案及解析
-
已知3.0g乙烷C2H6完全燃烧在常温下放出的热量为156kJ,则下列表示乙烷燃烧热的热化学方程式书写正确的是( )
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) △H=-3120kJ/mol
B.C2H6(g)+
O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
C.C2H6(g)+
O2(g)=2CO2(g)+3H2O(g) △H=-1560kJ/mol
D.C2H6(g)+
O2(g)=2CO2(g)+3H2O(1) △H=-1560kJ/mol
难度: 简单查看答案及解析
-
在一密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A.SO2为 0.8mol/L,O2为0.4mol/L
B.SO2为0.5mol/L
C.SO3为0.8mol/L
D.SO2、SO3一定均为0.3mol/L
难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1molX气体和2 molY气体,发生如下反应:X(g) + 2Y(g)
2Z(g) 此反应达到平衡的标志是( )
A.正反应和逆反应的速率都为零
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
难度: 中等查看答案及解析
-
在恒温条件下,将气体X、Y充入2 L密闭容器中反应生成气体Z。若各气体的物质的量随时间变化曲线如图所示,下列描述正确的是( )
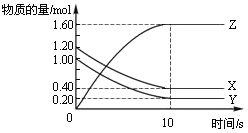
A.前10s内 v(X)=0.08mol·L-1·s-1
B.该反应的平衡常数K=32
C.平衡时X、Y的转化率相同
D.达到平衡后,将容器体积扩大为 4 L,平衡向逆反应方向移动
难度: 简单查看答案及解析
-
下列过程中,需要增大化学反应速率的是
A.钢铁腐蚀 B.食物腐败 C.工业合成氨 D.塑料老化
难度: 简单查看答案及解析
-
反应mX(g)+nY(g)
pZ(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是( )
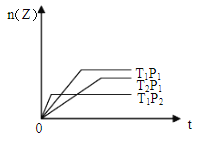
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
难度: 中等查看答案及解析
-
下列说法正确的是
A.等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.由C(金刚石)==C(石墨)ΔH=" -1.9" kJ·mol-1可知,金刚石比石墨稳定
D.NH3的稳定性强,是因为其分子之间存在氢键
难度: 中等查看答案及解析
-
用过量铁片与稀盐酸反应,为加快其反应速率而生成氢气的量不变,下列措施中可行的是①以铁屑代替铁片 ②用过量锌片代替铁片 ③在稀盐酸中加入少量CuSO4溶液④在稀盐酸中加入CH3COONa固体⑤在稀盐酸中加入等物质的量浓度的硫酸⑥在稀盐酸中加入硫酸钾溶液 ⑦微热(不考虑HCl的挥发)⑧在稀盐酸中加入NaNO3固体
A.除④外 B.除④⑤⑥⑧外 C.除④⑥外 D.全部都可行
难度: 中等查看答案及解析
-
在1L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)
4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是
A.0.225 mol / L·s B.0.15 mol / L·s
C.0.45 mol / L·s D.0.9 mol / L·s
难度: 中等查看答案及解析