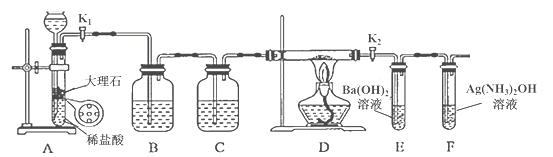
-
化学与生活密切相关,下列说法不正确的是
A.Na2CO3属于盐类,但其溶液显碱性,可用作食用碱
B.Al(OH)3可用于中和过多的胃酸
C.人体摄入大量铝盐易患“老年性痴呆”,明矾不宜大量作净水剂
D.PM2.5是指粒径不大于2.5μm 的可吸入颗粒物,其分散于大气后一定形成胶体
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与原理都正确的是
选项
目的
分离方法
原理
A
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离氢氧化铁胶体和氯化钠溶液
过滤
胶粒不能通过滤纸,离子可以通过
C
除去KNO3溶液中混有的少量NaCl
蒸发结晶
KNO3的溶解度随温度变化很大
D
除去丁醇(沸点117.5℃)中的甲醇
(沸点64.7℃)
蒸馏
丁醇与甲醇的沸点相差较大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验操作、现象或结论不正确的是
选项
操作
现象
结论
A
将一小块钠投入到硫酸铜溶液中
有红色物质生成
钠与硫酸铜溶液发生置换反应
B
向饱和Na2CO3 溶液中通入足量CO2
溶液变浑浊
析出了NaHCO3晶体
C
用洁净的铁丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中有Na+,可能含K+
D
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化不滴落
氧化铝的熔点高
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.0.5 mol NO2与11.2 L O3所含的分子数均为0.5 NA
B.同温同压下,相同体积的氢气和氦气所含原子数均为NA
C.7.8 g Na2O2与足量水反应,转移电子数目为0.1NA
D.0.5 mol Fe与足量盐酸或足量水蒸气反应,转移电子数目均为NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
B.用醋酸除去水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:3Ba2++6OH-+2Al3++ 3SO42-=3BaSO4↓+2Al(OH)3↓
D.FeI2溶液中通入过量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
难度: 中等查看答案及解析
-
下列说法正确的是
A.蒸馏结束后,应先停止通冷却水,再停止加热,待装置冷却后,再拆卸蒸馏装置
B.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
C.配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
D.向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaAlO2溶液:OH-、Na+、Cl-、SO42-
B.使紫色石蕊变红的溶液中:CO32-、Fe3+、NO3-、S2-
C.加入Al能放出H2的溶液中:Mg2+、NH4+、K+、SO42-
D.澄清透明的溶液中:Fe2+、MnO4-、NO3-、SO42-
难度: 中等查看答案及解析
-
下列有关钠及其化合物性质的说法正确的是
A.等质量的NaHCO3与Na2CO3分别与等浓度的盐酸完全反应时,产生CO2的物质的量相等
B.将1 mol甲醇(CH4O)完全燃烧生成的CO2和水蒸气通过足量的Na2O2固体,充分反应后固体增重32 g
C.取ag Na2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数
D.鉴别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液
难度: 中等查看答案及解析
-
下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
难度: 中等查看答案及解析
-
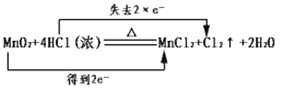
某同学设计如下装置进行铁与水反应的实验,虚线框处的装置用来检验生成的气体。下列说法正确的是(已知:Fe + 2Fe3+ = 3Fe2+)
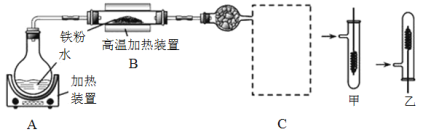
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲
C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑变红
D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有Fe3+
难度: 中等查看答案及解析
-
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A. 1mol/L B. 2 mol/L C. 0.5 mol/L D. 1.5 mol/L
难度: 困难查看答案及解析
-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
A.滴加KI溶液时,转移2 mol e-时生成1mol白色沉淀
B.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
C.通入SO2时,SO2与I2反应,I2作还原剂
D.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
难度: 困难查看答案及解析
-
向体积相同的甲、乙两容器中分别通入一定量的CO2和N2O,下列说法不正确的是( )
A.标准状况下,当两容器气体密度相同,则气体的物质的量相同
B.相同温度下,向甲容器中通入一定的N2,使得两容器中氮原子和氧原子数均相同,此时甲、乙两容器的压强之比为2:3
C.0.5 mol CO2和N2O的混合气体,所含电子数一定为11NA
D.同温同压下,两容器中气体质量相同
难度: 中等查看答案及解析
-
下列微粒在溶液中的还原性和氧化性强弱如下:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3溶液和生成物的物质的量关系曲线如图所示,则x的值为
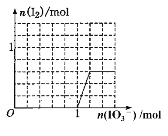
A.3mol
B.4mol
C.3.5mol
D.5mol
难度: 中等查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
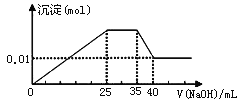
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
D.实验所加的NaOH的浓度为2mol·L-1
难度: 困难查看答案及解析