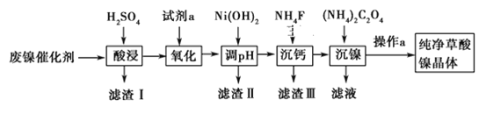
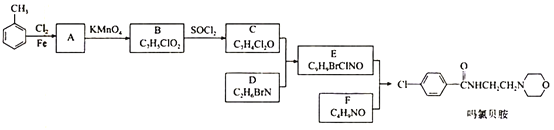
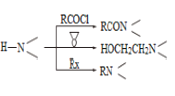
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
难度: 中等查看答案及解析
-
化学与社会、生产、生活密切相关,下列说法不正确的是( )
A.海水淡化可以解决淡水危机,用光催化分解代替电解水制氢气可实现节能环保
B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
C.普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液
D.用于3D打印材料的光敏树脂是纯净物
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数值,下列说法正确的是( )
A.含NA个CO32-的Na2CO3溶液中,Na+数目小于2 NA
B.100g质量分数为46%的乙醇水溶液中氧原子数为4NA
C.常温下,1L pH=3的醋酸溶液稀释到10 L时,溶液中H+的数目大于0.01NA
D.用惰性电极电解KOH溶液,若阳极产生5.6 L气体,则电路中通过0.5NA电子
难度: 中等查看答案及解析
-
聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图
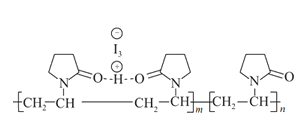 ,下列说法不正确的是( )
,下列说法不正确的是( )A.聚维酮的单体是
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质 D.聚维酮在一定条件下能发生水解反应
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
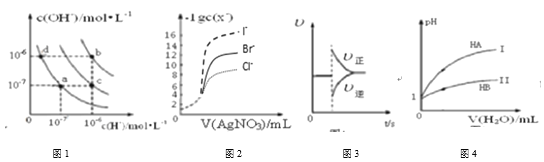
A.图1中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
B.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl-
C.图3表示在N2(g)+3H2(g)
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g)
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A.①②③ B.②④⑤ C.②⑤ D.④⑤
难度: 简单查看答案及解析
-
三位分别来自法国、美国、荷兰的科学家,因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是
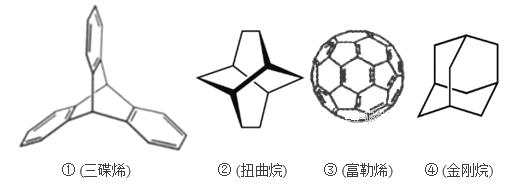
A. ①④互为同分异构体 B. ①②③④均属于烃
C. ①③均能发生加成反应 D. ①②③④的一氯代物均只有1种
难度: 中等查看答案及解析
-
在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
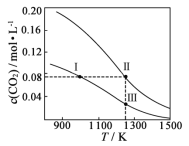
A.反应CO2(g)+C(s)
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向0.1 mol·L-1氨水中加入少量水,pH减小,
减小
B.同浓度的下列溶液中,① NH4HSO4 ②NH4Cl ③NH3·H2O ④CH3COONH4 ⑤NH4ClO,c(NH4+)由大到小的顺序是:①>②>④>⑤>③
C.0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-)
D.常温下,浓度均为0.1 mol·L-1L NaA和HA溶液中pH=9,则c (HA)>c(A-)>c(Na+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
红色基B(2-氨基-5-硝基苯甲醚)的结构简式如图所示,它主要用于棉纤维织物的染色,也用于制一些有机颜料,则分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位关系的同分异构体的数目(包括红色基B)为
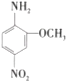
A.7种 B.8种 C.9种 D.10种
难度: 中等查看答案及解析
-
T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a
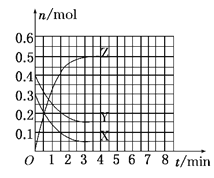 图b
图b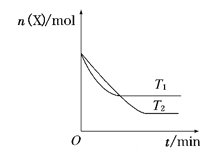
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
难度: 中等查看答案及解析
-
以下实验操作方法以及结论错误的是( )
①用燃烧的方法鉴别乙醇、四氯化碳、苯
②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去
③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸、氢氧化钠、酸碱指示剂。
④向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则 Ksp(BaCO3)﹤Ksp(BaSO4)
⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离
⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液
⑦用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。
A.②③④⑤⑥ B.①②⑥⑦ C.③④⑤⑥ D.②④⑤⑥
难度: 中等查看答案及解析
-
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是
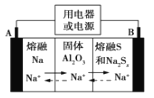
A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
难度: 中等查看答案及解析
-
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:
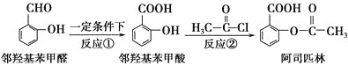
下列说法正确的是( )
A.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
B.邻羟基苯甲醛分子中所有的原子不可能在同一平面
C.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
D.反应②中加入适量的NaHCO3可提高阿司匹林的产率
难度: 中等查看答案及解析
-
2L甲醛气体与xL的氧气混合点燃,反应后氧气无剩余,生成的混合气体的体积为aL(气体体积均在120°C,101kPa时测定),并将此aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL。若a-b=3.5,则x的值为
A.2 B.4 C.1.75 D.3.5
难度: 困难查看答案及解析
-
25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是
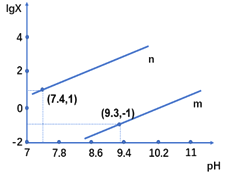
A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
难度: 中等查看答案及解析