-
(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应:
)在刚性容器内发生反应: (g)+ I2(g)
(g)+ I2(g)
 (g)+2HI(g) ΔH=+89.3 kJ·mol −1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol −1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中 =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
-
工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热的△H1=-283.0kJ·mol-l,②N2(g)+O2(g)  2NO(g) △H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)
2NO(g) △H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)  N2(g)+2CO2(g); △H=___。
N2(g)+2CO2(g); △H=___。
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.
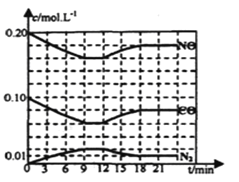
①该反应第一次达到平衡时的平衡常数为________。
②第12min时改变的条件是________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将________移动(填“正向”、“逆向”或“不”).
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是________。

②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
-
研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I.已知:①N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
②CO的燃烧热△H=-283 kJ·mol-1。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为________________________________。
(2)一定温度下,在恒容密闭容器中充入1 mol NO和2 mol CO进行该反应,下列不能判断反应达到化学平衡状态的是___________(用序号填空)
①单位时间内消耗a mol CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:

(3)T1______T2(填>、<或=,下同),该反应△H________0。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=________。
(5)甲容器中NO2平衡转化率为__________,T1时该反应的平衡常数为__________。
-
研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)  N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
| t/s | 0 | 3 | 6 | 12 | 24 | 36 |
| 甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
| 乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g),再以N2O4、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y。

(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
-
研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1 ②CO的燃烧热△H=-283 kJ·mol-1。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列不能判断反应达到化学平衡状态的是_______(用序号填空))
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
| t/s | 0 | 3 | 6 | 12 | 24 | 36 |
| 甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
| 乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1_____________T2(填>、<或=,下同),该反应ΔH______________0。
(4)甲容器中,0~3s内的平均反应速率υ(NO2)=______________________。
(5)甲容器中NO2平衡转化率为___________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g),再以N2O4、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y。
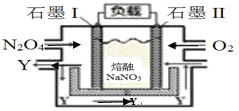
(6)石墨I为__________极(选填正、负),Y化学式为____________。
(7)II电极反应式为_________________________________________。
-
研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1 ②CO的燃烧热△H=-283 kJ·mol-1。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列不能判断反应达到化学平衡状态的是_______(用序号填空))
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
| t/s | 0 | 3 | 6 | 12 | 24 | 36 |
| 甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
| 乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1_____________T2(填>、<或=,下同),该反应ΔH______________0。
(4)甲容器中,0~3s内的平均反应速率υ(NO2)=______________________。
(5)甲容器中NO2平衡转化率为___________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g),再以N2O4、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y。

(6)石墨I为__________极(选填正、负),Y化学式为____________。
(7)II电极反应式为_________________________________________。
-
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的△H=____kJ·mol-l。
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的 。
。
①则该反应的平衡常数K=______。若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N2、0.2 mol的NO,平衡将______移动(填“向左”、“向右”或“不”)。
②下列各种情况,可说明该反应已经达到平衡的是______。
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
③在t2时刻,将容器迅速压缩到原容积的 ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。

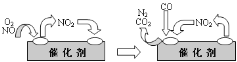
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式_________。
-
(12分)(1)已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1266.8kJ/mol
反应Ⅱ:N2(g) + O2(g)== 2NO(g) △=+180.5kJ/mol
它们的平衡常数依次为K1、K2
①写出氨高温催化氧化生成NO的热化学方程式 ,该反应的化学平衡常数的表达式K= (用含K1、K2的代数式表示)。
②反应Ⅰ可设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为: 。该电池使用过程中,正极附近溶液的pH将 (填“升高”、“降低”或“不变”)。
(2)已知:N2(g) +3H2(g)  2NH3(g) △H=-92kJ/mol。
2NH3(g) △H=-92kJ/mol。
①为提高H2的转化率,宜采取的措施有 (填字母)
A.及时移出氨 B.升高温度
C.使用催化剂 D.循环利用和不断补充N2
②在一定温度、压强下,将N2和H2按体积比1:3在密闭容器中混合,当反应达平衡时,测得平衡混合气体中NH3的体积分数为25%,此时H2的转化率为 。
-
氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为  。
。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
-
目前,对CO、NOx的综合利用是科学家研究的热点。回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ∆H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ∆H2=-566kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ∆H3=-116.2kJ·mol-1
写出CO和NO2反应生成N2的热化学方程式:____。
(2)制备AlCl3的实际生产过程中,常加入足量的碳粉,反应后生成CO(g)。T℃时,向恒容密闭容器中加入3mol Al2O3(s)、8mol C(s)和3.3mol Cl2(g),发生反应。Cl2的浓度变化如图1所示;图2为20min后改变容器中条件,平衡体系的反应速率(v)随时间(t)的变化关系,且四个阶段都各改变一种不同的条件。

①容器中发生反应的化学方程式为___。
②0~15min内,该反应的平均速率v(CO)=___mol·L-1·min-1。
③T℃时,该反应的平衡常数K=___。
④15min时的平衡常数K(15)、44 min时的平衡常数K(44)与55min时的平衡常数K(55)的大小关系为____。
(3)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
A.容器中气体的密度不发生变化
B.NO2和O2的体积比保持不变
C.v正(NO2)=2v逆(N2O5)
D.气体的平均相对分子质量为43.2,且保持不变
)在刚性容器内发生反应:
(g)+ I2(g)
(g)+2HI(g) ΔH=+89.3 kJ·mol −1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。








