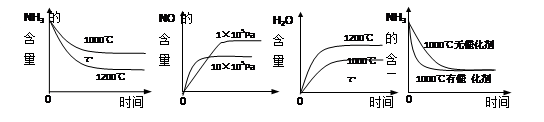-
(12分)(1)已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1266.8kJ/mol
反应Ⅱ:N2(g) + O2(g)== 2NO(g) △=+180.5kJ/mol
它们的平衡常数依次为K1、K2
①写出氨高温催化氧化生成NO的热化学方程式 ,该反应的化学平衡常数的表达式K= (用含K1、K2的代数式表示)。
②反应Ⅰ可设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为: 。该电池使用过程中,正极附近溶液的pH将 (填“升高”、“降低”或“不变”)。
(2)已知:N2(g) +3H2(g)  2NH3(g) △H=-92kJ/mol。
2NH3(g) △H=-92kJ/mol。
①为提高H2的转化率,宜采取的措施有 (填字母)
A.及时移出氨 B.升高温度
C.使用催化剂 D.循环利用和不断补充N2
②在一定温度、压强下,将N2和H2按体积比1:3在密闭容器中混合,当反应达平衡时,测得平衡混合气体中NH3的体积分数为25%,此时H2的转化率为 。
-
氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+ O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g) N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③0〜3min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
-
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和②副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+905kJ
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)+1268kJ
有关物质产率与温度的关系如图.下列说法正确的是( )
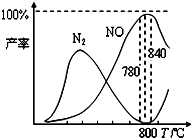
A.加压可提高NH3生成NO的转化率
B.工业上氨催化氧化生成NO时,反应温度最好控制在780℃以下
C.达到平衡后,保持其它条件不变,再充入2mol O2反应①的平衡常数K保持不变
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g)⇌2NO(g)-363kJ
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。

(1)由反应①②可知反应③N2(g) + O2(g) 2NO(g)的反应热ΔH=________。
2NO(g)的反应热ΔH=________。
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________。
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二:________(用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________(填“正极”或“负极”),电极方程式为________。
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
有关物质产率与温度的关系如甲图.
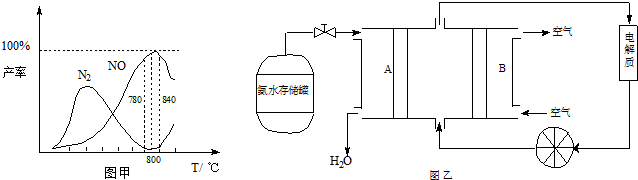
(1)由反应①②可知反应③N2(g)+O2(g)⇌2NO(g)的反应热△H=________
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,原因二:________(用文字和离子方程式说明).
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________.
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________(填“正极”或“负极”),电极方程式为________.
-
(1)已知:N2(g)+3H2(g) 2NH3(g)ΔH=﹣92.4 kJ•
2NH3(g)ΔH=﹣92.4 kJ• ,
,
2H2(g)+O2(g)====2H2O(l)ΔH=﹣571.6 kJ• ,
,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=_______。
4NH3(g)+3O2(g) ΔH=_______。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:

上图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出CO2和NO反应生成NO2和CO的热化学方程式:__________________________________。在反应体系中加入催化剂,E1和E2的变化是:E1__,E2__(填“增大”“减小”或“不变”),对反应热是否有影响?__(填“是”或“否”),原因是________________________________________。
(3)常温常压下断裂1 mol气体分子化学键所吸收的能量或形成1 mol气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):请完成下列问题。

热化学方程式2H2(g)+S2(g)===2H2S(g) ΔH=-229 kJ·mol-1,则X=________。
-
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a________0 (填“>”、“<”或“=”)。
(2)用水稀释0.1 mol·L-1氨水(设稀释时溶液温度不变),则溶液中随着水量的增加而减小的是下列的________(填序号):
A.c(NH3·H2O) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
(3)工业用氨制取硝酸的氧化反应为:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
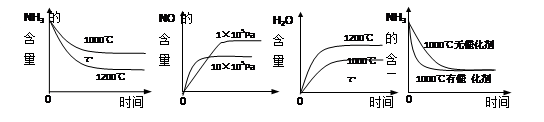
A B C D
(4)在1L容积固定的密闭容器中发生上述反应,部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
反应在第6 min到8min时改变了条件,改变的条件可能是___________________;在该条件下,平衡向_______移动(填“左”或“右”)。
-
氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:
①4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,
2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,
②H2(g)+1/2O2(g)===H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)===H2O(g) △H3=+44.0kJ·mol-1
反应①在任何温度下都能自发进行的原因为___________;NH3分解为N2和H2的热化学方程式______________________。
(2)在Co-Al催化剂体系中,压强P0下氨气以一定流速通过反应器,在相同时间下测转化率。得到不同催化剂下氨气转化率随温度变化曲线如下图。使反应的活化能最小的催化剂为___________。同一催化剂下,温度高时NH3的转化率接近平衡转化率的原因_______________________________。如果增大氨气浓度(其它条件不变),则b点对应的点可能为___________。(填“a”、“c”或“d”)
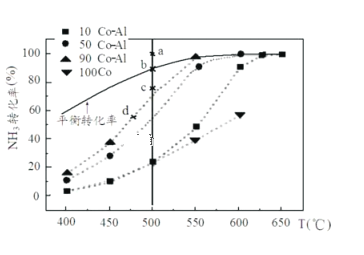
(3)T℃时,体积为2L的密闭容器中加入1.0molNH3和0.2molH2,20min达到平衡时,N2体积分数为20%,则T℃时平衡常数K=___________;0~20min时段,反应平均速率v(NH3)= _______;达到平衡后再加入1.0molNH3和0.2molH2,此时体系中v正___________v逆(填“>“<”或“=”)。
-
已知:①4NH3(g)+3O2(g) 2N2(g)+6H2O(g)ΔH=−1269kJ/mol
2N2(g)+6H2O(g)ΔH=−1269kJ/mol
②
下列说正确的是
A.断开1 mol O=O键比断开1 mol N≡N键所需能量多448 kJ
B.断开1 mol H―O键比断开1 mol H―N键所需能量相差约72.6 kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知 H―O键比H―N键弱
-
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。

① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如图所示。
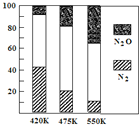
请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
2NH3(g) △H=-92kJ/mol。