-
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和②副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+905kJ
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)+1268kJ
有关物质产率与温度的关系如图.下列说法正确的是( )
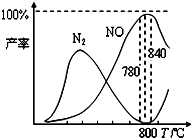
A.加压可提高NH3生成NO的转化率
B.工业上氨催化氧化生成NO时,反应温度最好控制在780℃以下
C.达到平衡后,保持其它条件不变,再充入2mol O2反应①的平衡常数K保持不变
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g)⇌2NO(g)-363kJ
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g)  2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。
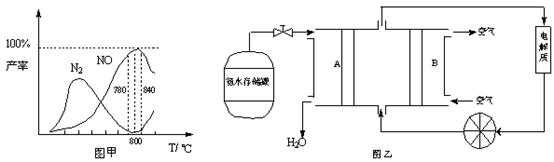
(1)由反应①②可知反应⑤N2(g) + O2(g)  2NO(g)的反应热ΔH=________________________
2NO(g)的反应热ΔH=________________________
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________________________
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二:________________________(用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________________________。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________________________(填“正极”或“负极”),电极方程式为________________________
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。

(1)由反应①②可知反应③N2(g) + O2(g) 2NO(g)的反应热ΔH=________。
2NO(g)的反应热ΔH=________。
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________。
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二:________(用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________(填“正极”或“负极”),电极方程式为________。
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
有关物质产率与温度的关系如甲图.
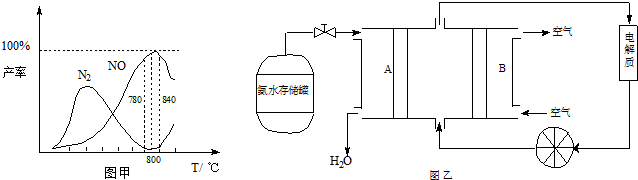
(1)由反应①②可知反应③N2(g)+O2(g)⇌2NO(g)的反应热△H=________
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,原因二:________(用文字和离子方程式说明).
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________.
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________(填“正极”或“负极”),电极方程式为________.
-
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905kJ•mol-1 ①4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1268kJ•mol-1 ②下列说法中正确的是( )

A.工业上氨催化氧化生成 NO时,最佳温度应控制在780~840℃之间
B.工业上采用物料比 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g)⇌2NO(g)△H=-181.5 kJ•mol-1
-
工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L•min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变 f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是________(填字母).
a.向装置中再充入O2 b.改变催化剂
c.增大压强 d.提高温度
-
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是

A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=-181.5kJ/mol
2NO(g) △H=-181.5kJ/mol
-
NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:4NH3(g)+5O2(g)  4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是______(填字母)。
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率。平衡时,NH3的转化率α(NH3 )=_________。
-
NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:4NH3(g)+5O2(g)  4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是______(填字母)。
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率。平衡时,NH3的转化率α(NH3 )=_________。
-
NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:
4NH3(g)+5O2(g)  4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是________(填字母)。
a.NH3和NO浓度相等
b.NO百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率和写出平衡常数K 的表达式(不必写出计算过程)。
①平衡常数的表达式K=________________;
②平衡时,NH3的转化率α(NH3 )=________________。
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应

2NO(g)的反应热ΔH=________。




