-
工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L•min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变 f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是________(填字母).
a.向装置中再充入O2 b.改变催化剂
c.增大压强 d.提高温度
-
某温度下,将4mol N2与8mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g)
 2NH3(g),达平衡时NH3的浓度为4mol/L.请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L.请回答下列问题:
(1)计算该温度下的平衡常数K;
(2)计算该条件下N2的转化率;
(3)如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率______;H2的转化率______(上述两空选填“增大”、“减小”或“不变”).
-
某温度下,将4mol N2与8mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),达平衡时NH3的浓度为4mol/L.请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L.请回答下列问题:
(1)计算该温度下的平衡常数K;
(2)计算该条件下N2的转化率;
(3)如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率 ;H2的转化率 (上述两空选填“增大”、“减小”或“不变”).
-
某温度下,将4mol N2与8 mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
⑴计算该温度下的平衡常数K;
⑵计算该条件下N2的转化率;
⑶如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率__________;H2的转化率__________(上述两空选填“增大”、“减小”或“不变”)。
-
某温度下,将4mol N2与8 mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
⑴计算该温度下的平衡常数K;
⑵计算该条件下N2的转化率;
⑶如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率__________;H2的转化率__________(上述两空选填“增大”、“减小”或“不变”)。
-
工业上合成尿素的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)。在一定温度和压强下,往容积可变的密闭容器内通入物质的量各为1mol的氨气和二氧化碳发生上述反应。下列说法中无法判断该反应一定达到化学平衡的是
CO(NH2)2(s)+H2O(g)。在一定温度和压强下,往容积可变的密闭容器内通入物质的量各为1mol的氨气和二氧化碳发生上述反应。下列说法中无法判断该反应一定达到化学平衡的是
A.打断amol的N-H键同时消耗a/6mol的尿素
B.密闭容器中混合气体的平均摩尔质量保持不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中二氧化碳的体积分数保持不变
-
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
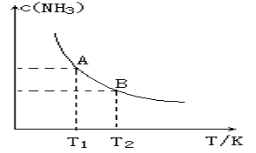
(1)当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为 。N2的转化率
(3)T1温度下该反应的化学平衡常数K1= 。
(4)500℃时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L, c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态______(填是或否),此时反应速率是v正________v逆(填 >, <, =).
(5)根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
已知:①2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③CO的燃烧热△H =-c kJ·mol-1。
写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
-
Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新 研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H =-b kJ·mol-1;CO的燃烧热△H =-c kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
-
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
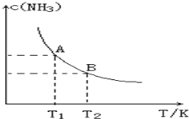
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0(填“>”或“<”)。
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_________,N2的转化率___________。
(3)T1温度下该反应的化学平衡常数K1=______________。
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=)。
-
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
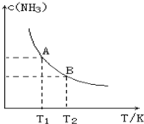
(1)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_____________。
(2)T1温度下该反应的化学平衡常数K1=______________。
(3)T1温度时,若测得容器中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态__________(填是或否),此时反应速率是v正_______v逆(填>或<或=)。
4NO(g)+6H2O(g);


