-
氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:
①4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,
2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,
②H2(g)+1/2O2(g)===H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)===H2O(g) △H3=+44.0kJ·mol-1
反应①在任何温度下都能自发进行的原因为___________;NH3分解为N2和H2的热化学方程式______________________。
(2)在Co-Al催化剂体系中,压强P0下氨气以一定流速通过反应器,在相同时间下测转化率。得到不同催化剂下氨气转化率随温度变化曲线如下图。使反应的活化能最小的催化剂为___________。同一催化剂下,温度高时NH3的转化率接近平衡转化率的原因_______________________________。如果增大氨气浓度(其它条件不变),则b点对应的点可能为___________。(填“a”、“c”或“d”)
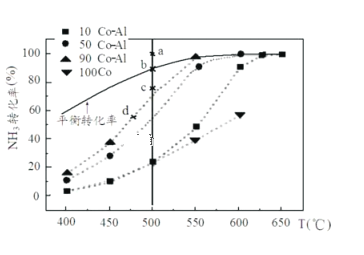
(3)T℃时,体积为2L的密闭容器中加入1.0molNH3和0.2molH2,20min达到平衡时,N2体积分数为20%,则T℃时平衡常数K=___________;0~20min时段,反应平均速率v(NH3)= _______;达到平衡后再加入1.0molNH3和0.2molH2,此时体系中v正___________v逆(填“>“<”或“=”)。
-
氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+ O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g) N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③0〜3min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
-
氨气和氧气在某催化剂和不同温度下生成的产物如图所示。已知在800 ℃下,容积固定的密闭容器中发生反应①、②:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ①
2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ②
4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
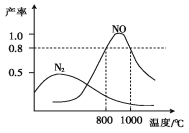
A.v(N2)=v(NO) B.反应①的焓变ΔH保持恒定
C.体系的密度不再发生变化 D.混合气体的平均相对分子质量不再发生变化
-
氨气和氧气在某催化剂和不同温度下生成的产物如图所示。已知在800 ℃下,容积固定的密闭容器中发生反应①、②:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ①
2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ②
4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
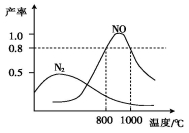
A.v(N2)=v(NO) B.反应①的焓变ΔH保持恒定
C.体系的密度不再发生变化 D.混合气体的平均相对分子质量不再发生变化
-
根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式为2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
| T/℃ | 30 | 40 | 50 |
| NH3的平衡浓度/(×10-6mol/L) | 4.8 | 5.9 | 6.0 |
(1)该反应的△H_____0,△S________0(填“>”、“˂”或“=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1___K2(填“>”、“˂”或“=”)
-
(6分)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH= + 1 530 kJ/mol
4NH3(g)+3O2(g) ΔH= + 1 530 kJ/mol
又知:H2O(l) H2O(g) ΔH= + 44.0 kJ/mol
H2O(g) ΔH= + 44.0 kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
-
(1)在其他条件不变的情况下,研究改变起始氢气物质的量
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图2):
4NH3+5O2⇌4NO+6H2O,4NH3+3O2⇌2N2+6H2O
温度较低时以生成______为主,温度高于900℃时,NO产率下降的原因是______.
-
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和②副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+905kJ
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)+1268kJ
有关物质产率与温度的关系如图.下列说法正确的是( )
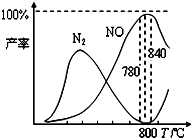
A.加压可提高NH3生成NO的转化率
B.工业上氨催化氧化生成NO时,反应温度最好控制在780℃以下
C.达到平衡后,保持其它条件不变,再充入2mol O2反应①的平衡常数K保持不变
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g)⇌2NO(g)-363kJ
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。

(1)由反应①②可知反应③N2(g) + O2(g) 2NO(g)的反应热ΔH=________。
2NO(g)的反应热ΔH=________。
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________。
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二:________(用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________(填“正极”或“负极”),电极方程式为________。
-
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
有关物质产率与温度的关系如甲图.
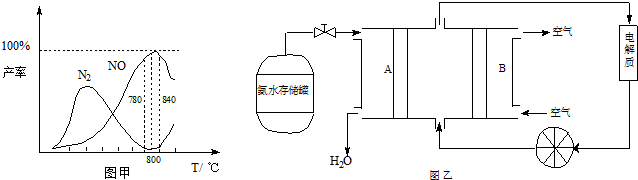
(1)由反应①②可知反应③N2(g)+O2(g)⇌2NO(g)的反应热△H=________
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在________
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,原因二:________(用文字和离子方程式说明).
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为________.
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为________(填“正极”或“负极”),电极方程式为________.
2N2(g)+6H2O(g) △H=-1266.6kJ·mol-1,






