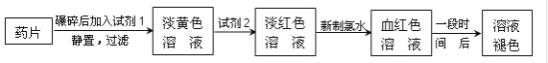
-
下列离子方程式书写正确的是
A. 铜跟硝酸银溶液反应: Cu+Ag+===Cu2++Ag
B. 碳酸钙与盐酸反应: CO32-+2H+===CO2↑+H2O
C. 硫酸与氢氧化钡溶液反应: H++ SO42-+Ba2++OH-===BaSO4↓+H2O
D. Ba(OH)2与 CuSO4溶液反应: Cu2++ SO42-+Ba2++2OH-===BaSO4↓+Cu(OH)2↓
难度: 中等查看答案及解析
-
下列物质的分类合理的是
A. 酸性氧化物:CO2、SiO2、SO2、NO2
B. 碱:烧碱、纯碱、苛性钾、氢氧化钡
C. 混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体
D. 碱性氧化物:Na2O、CaO、MgO、Al2O3
难度: 中等查看答案及解析
-
某溶液中含有大量Fe2+、Al3+、Fe3+、Na+、Cl-、SO42-离子,其中加入足量Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是
A.Na+、Fe2+ B.Al3+、SO42- C.Fe3+、SO42- D.Al3+、Cl-
难度: 中等查看答案及解析
-
在酸性条件下,可发生如下反应:ClO3-+2M3++4H2O=M2O7n-+Cl-+8H+,M2O7n- 中M的化合价是
A.+4 B.+5 C.+6 D.+7
难度: 简单查看答案及解析
-
下列变化,加入还原剂可以实现的是
A.Ag→Ag+ B.Cu→CuO C.Fe2O3→FeO D.NO→NO2
难度: 中等查看答案及解析
-
已知硝酸能将Fe2+氧化为Fe3+.下列物质反应后能使KSCN溶液变红的是( )
①过量的Fe与Cl2反应
②Fe和过量稀硫酸反应
③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中
⑤向Fe(NO3)2溶液中加入过量稀硫酸.
A.只有① B.只有①③⑤ C.只有①②③ D.全部
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,将22.4LCl2通入水中发生反应,转移的电子数为NA
B.1molO2作氧化剂时转移电子数一定为4NA
C.23gNa与O2充分反应生成Na2O和Na2O2的混合物,消耗O2分子数在0.25NA和0.5NA之间
D.在Na2O2与CO2的反应中,固体质量每增重28g,转移电子数2NA
难度: 中等查看答案及解析
-
制印刷电路板的“腐蚀液”的应用原理:2FeCl3+Cu=2FeCl2+CuCl2。向盛有FeCl3溶液的烧杯中同时加入一定量的铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中铜、铁均有 B.烧杯中Fe3+、Cu2+、Fe2+均有
C.烧杯中Cu和Cu2+均有 D.烧杯中Cu2+、Fe2+、Cu和Fe均有
难度: 中等查看答案及解析
-
a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱 D.d单质的氧化性比a单质的氧化性强
难度: 中等查看答案及解析
-
下列物质中,既属于钾盐又属于碳酸盐的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
在无色溶液中,下列各组离子能够大量共存的是( )
A.K+、Ba2+、Cl-、SO42- B.H+、HCO3-、Cl-、K+
C.Cl-、Na+、NO3-、Ca2+ D.Cu2+、NO3-、SO4-、Cl-
难度: 简单查看答案及解析
-
氯气及其化合物在生产和生活中有重要应用,下列关于氯及其化合物的说法正确的是( )
A.NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现还原性
B.Cl2与烧碱溶液反应的实质是Cl2+OH-=Cl-+ClO-+H2O
C.氯气有毒,在通风橱中制备氯气可以消除氯气的污染
D.将Cl2通入淀粉-KI溶液,溶液变蓝色
难度: 中等查看答案及解析
-
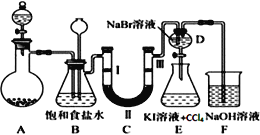
某化学兴趣小组利用MnO2和浓HCl 及如图装置制备Cl2。下列分析中不正确的是( )
A.A 中可用分液漏斗代替长颈漏斗 B.A 中缺少加热装置
C.B 中盛放的NaOH 溶液可以净化Cl2 D.D 中盛放的NaOH 溶液可以吸收尾气
难度: 中等查看答案及解析
-
300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
难度: 中等查看答案及解析
-
实验室里需用480mL 0.1mol•L-1的碳酸钠溶液,选取500mL容量瓶进行配制,以下操作正确的是
A.称取5.1g Na2CO3,加入500mL水
B.称取13.7g Na2CO3·10H2O,配成500mL溶液
C.称取5.3 Na2CO3,加入500mL水
D.称取14.3g Na2CO3·10H2O,配成500mL溶液
难度: 中等查看答案及解析
-
用容量瓶配制一定物质的量浓度的Na2CO3溶液时,下列各项中,可能导致其实际浓度偏低的是( )
A.在用天平称量时,托盘里的部分Na2CO3吸收了水分,形成了少量结晶水合物
B.Na2CO3溶解时放出热量,未冷却立即配制溶液
C.用蒸馏水洗涤溶解过Na2CO3固体的烧杯,并将洗涤后的溶液注入容量瓶
D.定容时俯视瓶颈刻度线
难度: 中等查看答案及解析
-
对下列各实验现象的判断正确的是( )
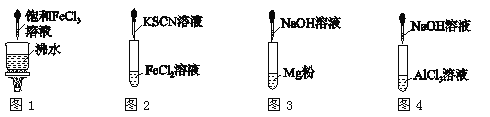
A.图1产生红褐色沉淀 B.图2溶液颜色变红
C.图3放出大量气体 D.图4先出现白色胶状沉淀,后沉淀溶解
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
向含等物质的量的FeCl3和AlCl3的混合溶液中逐滴加入NaOH溶液,下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的物质的量)( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列化学用语或命名正确的是
A. 次氯酸的结构式:H-Cl-O B. 含有10个中子的氧原子的符号:
C. S2-的结构示意图
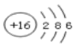 D. NH4Cl的电子式:
D. NH4Cl的电子式: 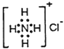
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
难度: 中等查看答案及解析
-
现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )
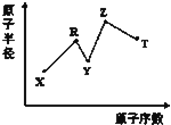
A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是
①含有金属元素的化合物一定是离子化合物
②第ⅠA族和第ⅦA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
⑦非极性键只存在于双原子单质分子中
⑧不同元素组成的多原子分子中的化学键一定都为极性键
A.①②⑤ B.④⑤⑥ C.①③④ D.②③⑤
难度: 简单查看答案及解析
-
下列各组物质中,都含有共价键,却又都不属于共价化合物的一组( )
A.Na2O2 Na2O B.KClO NaOH C.Br2 HBr D.HF H2O
难度: 中等查看答案及解析
-
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
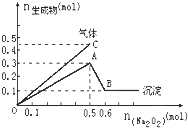
A.1:1:2 B.2:2:1 C.1:2:2 D.9:2:4
难度: 中等查看答案及解析
-
进行化学实验必须注意安全,下列说法不正确的是( )
A.不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛
B.不慎将碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,在慢慢倒入浓硫酸,并搅拌
D.洒在桌面上的酒精燃烧,立即用湿抹布盖灭
难度: 简单查看答案及解析
-
某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
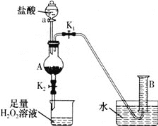
A.烧杯中H2O2溶液的作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.利用B装置不能准确测量生成氢气的体积
D.将反应后的溶液放入烧杯中再通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
难度: 中等查看答案及解析
-
下列有关Na2CO3和NaHCO3的叙述中,正确的是( )
A.NaHCO3俗名纯碱,Na2CO3俗名苏打
B.受热时,NaHCO3比Na2CO3容易分解
C.NaHCO3溶液显酸性,Na2CO3溶液显碱性
D.NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同
难度: 中等查看答案及解析
-
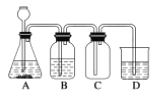
如图,A处通入Cl2,关闭B阀时,C中的湿润红色布条看不到明显变化; 打开B阀后,C中的湿润红色布条逐渐褪色。则D瓶中盛放的是
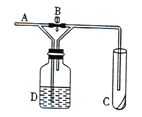
A.NaOH溶液 B.饱和NaCl溶液
C.浓硫酸 D.浓盐酸
难度: 中等查看答案及解析
-
金属钛有“未来金属”之称,具有低密度、高硬度等性能,化学性质稳定。钛的化合价主要有+4价和+3价,其中+3价钛极易被氧化。有关说法正确的是( )
A.金属钛就是钛合金
B.Ti2O3化学性质稳定
C.FeTiO3(钛酸亚铁)中钛的化合价为+3价
D.钛及其合金可广泛应用于航空领域
难度: 简单查看答案及解析