-
有机物命名正确的是
A. 2,3,5-三甲基己烷 B. 1,3-二甲基丁烷
C. 2,3-二甲基-2-乙基己烷 D. 2,3-二甲基-4-乙基戊烷
难度: 简单查看答案及解析
-
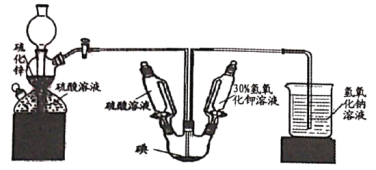
KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3包括以下两个反应:
①11KClO3+6I2+3H2O == 6KH(IO3)2 +3Cl2↑+5KCl
②KH(IO3)2+KOH==2KIO3+H2O
下列说法正确的是( )
A. 化合物KH(IO3)2中含有共价键、离子键和氢键等化学键
B. 反应①中每转移4mol电子生成2.24LCl2
C. 向淀粉溶液中加入少量碘盐,溶液会变蓝
D. 可用焰色反应实验证明碘盐中含有钾元素
难度: 中等查看答案及解析
-
美国《Science》上发表论文,宣布发现了一种 Al 的超原子结构,这种超原子(Al13)是以 1 个 Al 原子 在中心,12 个 Al 原子在表面形成的三角二十面体结构。这种超原子具有 40 个价电 子(价电 子即主族元 素的最外层电子数)时最稳定。请预测稳定的 Al13 所带的电荷为
A.-1 B.+2 C.+3 D.0
难度: 中等查看答案及解析
-
化学与生活、生产密切相关,下列说法错误的是 ( )
A.Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B.工业生产玻璃、水泥,均需要用石灰石为原料
C.将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D.纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
难度: 中等查看答案及解析
-
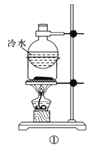
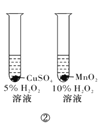
下列实验方案中,能达到相应实验目的的是
A.方案①用于分离I2和NH4I固体
B.方案②用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
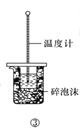
D.方案④用于比较醋酸和硼酸的酸性强弱
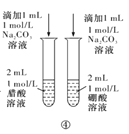
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是
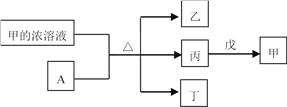
A.丁和戊中所含元素种类相同
B.简单离子半径大小:X<Y
C.气态氢化物的还原性:X>Z
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
难度: 中等查看答案及解析
-
下表中实验操作、现象和所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
用激光笔照射鸡蛋白水溶液
有丁达尔效应
鸡蛋白分子直径介于1nm~100nm
B
向某氯化亚铁溶液中加入Na2O2粉末
出现红褐色沉淀
说明原氯化亚铁已氧化变质
C
碳酸的盐X加热分解,产生的气体通入酸化的BaCl2溶液
产生白色沉淀
X可能是NaHCO3
D
湿润的KI淀粉试纸靠近气体Y
试纸变蓝
Y一定是Cl2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
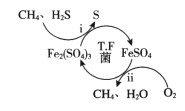
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
难度: 中等查看答案及解析
-
物质性质的差异与分子间作用力有关的是
A. 沸点:Cl2<I2 B. 热稳定性:HF>HCl
C. 硬度:晶体硅<金刚石 D. 熔点:MgO>NaCl
难度: 中等查看答案及解析
-
如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
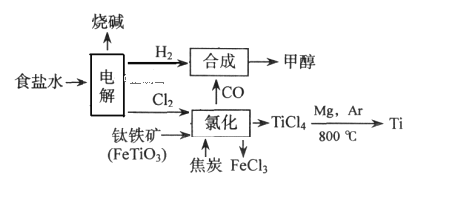
下列叙述正确的是( )
A.该流程中只有“电解”、“氯化”涉及氧化还原反应
B.“合成”反应中氧化剂与还原剂的物质的量之比为1:1
C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(条件省略)
D.上述流程中“Mg,Ar"可用“Mg,CO2”代替
难度: 简单查看答案及解析
-
我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52− − 4e− == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
难度: 困难查看答案及解析
-
下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是
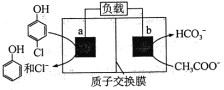
A.a、b极不能使用同种电极材料
B.工作时,a极的电势低于b极的电势
C.工作一段时间之后,a极区溶液的pH增大
D.b极的电极反应式为:CH3 COO-+4H2O-8e-=2HCO3-+9H+
难度: 困难查看答案及解析
-
电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是
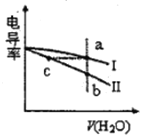
A.曲线I表示盐酸加水稀释过程中溶液电导率的变化
B.a、b、c三点溶液的pH:a>b>c
C.将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D.氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
难度: 中等查看答案及解析
-
某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
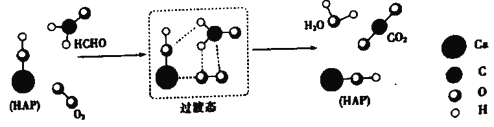
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2
CO2+H2O
难度: 中等查看答案及解析
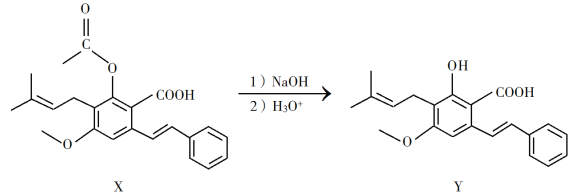
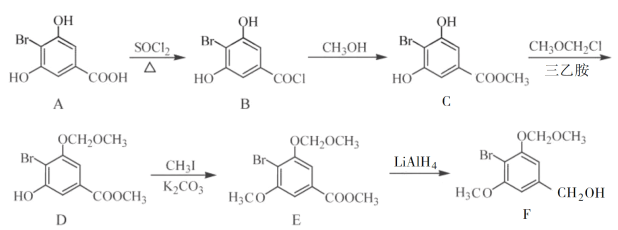
 (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以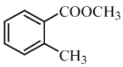 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备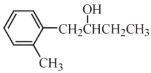 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________