-
“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g) S(l)+2CO2(g) △H1=37.4kJ·mol-1
S(l)+2CO2(g) △H1=37.4kJ·mol-1
b.S(l)+2H2O(g) 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g) CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
| 反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 4 | 0 |
| 10min | | 2 | |
| 20min | 0.2 | | |
①前10min内的平均反应速率v(CO)=______;在20min时,温度T2下,该反应的化学平衡常数为_______。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g) CH3OH(g)反应达到平衡状态的_____(填序号)。
CH3OH(g)反应达到平衡状态的_____(填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g) 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
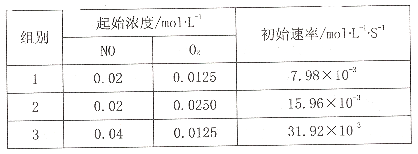
则k1=____,m=_____,n=_____。
-
“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g) S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g) 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g) CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
| 反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 4 | 0 |
| 10min | | 2 | |
| 20min | 0.2 | | |
①前10min内的平均反应速率v(CO)= _______;在20min时,温度T2下,该反应的化学平衡常数为________________。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g) CH3OH(g)反应达到平衡状态的________(填序号)。
CH3OH(g)反应达到平衡状态的________(填序号)。
a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g) 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
| 组别 | 起始浓度/mol·L-1 | 初始速率/ mol·L-1·S-1 |
| NO | O2 |
| 1 | 0.02 | 0.0125 | 7.98×10-3 |
| 2 | 0.02 | 0.0250 | 15.96×10-3 |
| 3 | 0.04 | 0.0125 | 31.92×10-3 |
则k1=____, m =_____, n =_____。
-
“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g) S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g) 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g) CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
| 反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 4 | 0 |
| 10min | | 2 | |
| 20min | 0.2 | | |
①前10min内的平均反应速率v(CO)= _______;在20min时,温度T2下,该反应的化学平衡常数为________________。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g) CH3OH(g)反应达到平衡状态的________(填序号)。
CH3OH(g)反应达到平衡状态的________(填序号)。
a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g) 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
| 组别 | 起始浓度/mol·L-1 | 初始速率/ mol·L-1·S-1 |
| NO | O2 |
| 1 | 0.02 | 0.0125 | 7.98×10-3 |
| 2 | 0.02 | 0.0250 | 15.96×10-3 |
| 3 | 0.04 | 0.0125 | 31.92×10-3 |
则k1=____, m =_____, n =_____。
-
“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
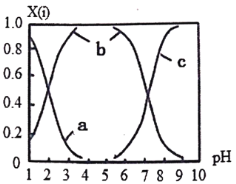
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g) 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
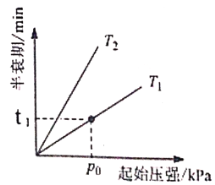
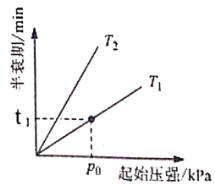
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
-
“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
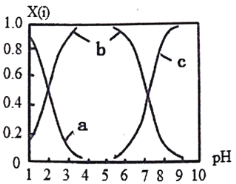
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g) 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
-
“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。

①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g) 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)

-
“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g) 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
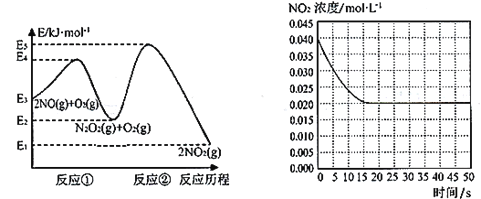
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
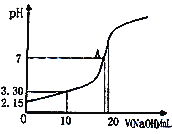
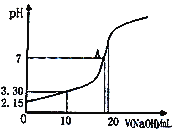
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
-
“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g) 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。

(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
-
环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。
相关化学键的键能如下表所示:
| 化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
| 键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO 2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
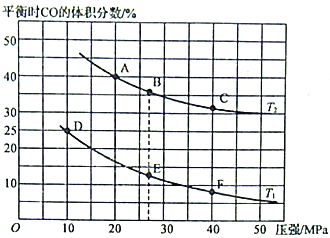
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=___________MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的___________点(填标号)。
(3)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(4)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中 ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
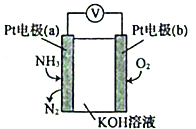
①电极b上发生的是___________反应(填“氧化”或“还原”)。
②电极a的电极反应为_______________________。
-
环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
| 化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
| 键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中 ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g)反应达到平衡状态的________(填序号)。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。












