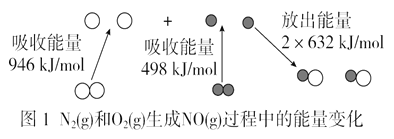
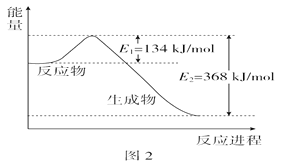
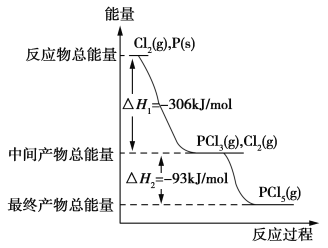
-
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s) + 2Cl2(g)=TiCl4(l) + O2(g) △H=+140.5 kJ/mol
C(s,石墨) + 1/2O2(g)=CO(g) △H=-110.5 kJ/mol
则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨)=TiCl4(l) + 2CO(g) 的△H是
A. +80.5 kJ/mol B. +30.0 kJ/mol C. -30.0 kJ/mol D. -80.5 kJ/mol
难度: 中等查看答案及解析
-
热方程式C(s)+H2O(g)=CO(g)+H2(g)ΔH=131.3 kJ·mol-1表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成1mol一氧化碳和1mol氢气,并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳和1 mol氢气,并吸收131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸收131.3kJ热量
难度: 简单查看答案及解析
-
反应4NH3+5O2
4NO+6H2O在10 L密闭容器中进行,半分钟后水蒸气的物质的量增加了0.45mol,则此反应的平均反应速率v(X)可表示为( )
A.v(NH3)=0.002mol/(L·s) B.v(O2)=0.001mol/(L·s)
C.v(NO)=0.001mol/(L·s) D.v(H2O)=0.001mol/(L·s)
难度: 简单查看答案及解析
-
氢能是一种高效洁净的新能源,用氢作能源的燃料电池汽车备受青睐。氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.②④ D.③④
难度: 简单查看答案及解析
-
下列关于反应能量的说法正确的是
A. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH= -216 kJ·mol-1,则反应物的总能量大于生成物的总能量
B. 若一定条件下,A=B ΔH<0,说明A物质比B物质稳定
C. 101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1
D. H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1,含1mol NaOH的溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量
难度: 中等查看答案及解析
-
下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是
A.
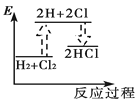 B.
B. 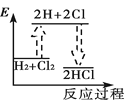 C.
C.  D.
D. 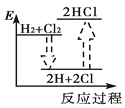
难度: 中等查看答案及解析
-
在下列各说法中,正确的是
A. ΔH>0表示放热反应,ΔH<0表示吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
已知在25℃、101kPa下,0.5mol辛烷C8H18燃烧生成二氧化碳和液态水时放出2759kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+
O2(g)=8CO2(g)+9H2O(g) ΔH= -48.40 kJ·mol-1
B.C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH= -5518 kJ·mol-1
C.C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH= +5518 kJ·mol-1
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH= +11036 kJ·mol-1
难度: 简单查看答案及解析
-
A(g)+B(g)=C(g)+D(g)反应过程中的能量变化如图所示,则下列表述正确的是( )
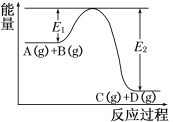
A.A(g)+B(g)=C(g)+D(g) ΔH<0
B.A(g)+B(g)=C(g)+D(g) ΔH>0
C.A+B=C+D ΔH<0
D.C+D=A+B ΔH<0
难度: 简单查看答案及解析
-
下列说法正确的是
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件一定能发生反应
C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应
D.当△H<0时表明反应为吸热反应
难度: 中等查看答案及解析
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g) + 4O2(g) =2CO2(g) + 4H2O(l)ΔH= +890 kJ·mol-1
B.CH4(g) + 2O2(g) = CO2(g) +2H2O(l)ΔH= +890 kJ·mol-1
C.CH4(g) + 2O2(g) = CO2(g) +2H2O(l)ΔH=-890 kJ·mol-1
D.2CH4(g) + 4O2(g) = 2CO2(g) + 4H2O(l)ΔH= -890 kJ·mol-1
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1367.0kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3kJ·mol-1(中和热)
C.S(s)+O2(g)=SO2(g) ΔH=-296.8kJ·mol-1(反应热)
D.2NO2=O2+2NO ΔH=+116.2kJ·mol-1(反应热)
难度: 中等查看答案及解析
-
已知:H2S与不足量的O2燃烧时,生成S和H2O。根据以下三个热化学方程式:
2H2S(g)+3O2(g)2SO2(g)+2H2O(l) ΔH1
2H2S(g)+O2(g)2S(s)+2H2O(l) ΔH2
2H2S(g)+O2(g)2S(s)+2H2O(g) ΔH3
判断ΔH1、ΔH2、ΔH3三者大小关系正确的是( )
A. ΔH3>ΔH2>ΔH1 B. ΔH1>ΔH3>ΔH2
C. ΔH1>ΔH2>ΔH3 D. ΔH2>ΔH1>ΔH3
难度: 简单查看答案及解析
-
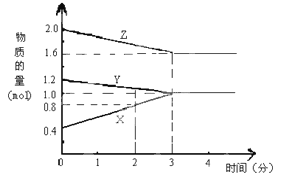
在一定条件,将A2和B2两种气体通入1 L密闭容器中,发生反应:xA2(g)+yB2(g)
2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v (C)=1 mol·L-1·s-1。则x和y的值分别为:
A.1和3 B.3和1 C.2和3 D.3和2
难度: 简单查看答案及解析
-
反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1④v(D)=0.45 mol·L-1·s-1。下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.①>②>③>④ C.①>④>②=③ D.④>③>②>①
难度: 中等查看答案及解析
-
下列属于放热反应的是( )
A.铝和盐酸反应 B.焦炭和二氧化碳共热
C.石灰石的分解 D.氯化铵与氢氧化钡反应
难度: 简单查看答案及解析
-
在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
难度: 中等查看答案及解析
-
N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )

A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
难度: 中等查看答案及解析
-
在下列反应中,反应物的总能量低于生成物的总能量的是
A.2H2+O2
2H2O B.CaCO3
CaO+CO2↑
C.CaO+CO2=CaCO3 D.C2H5OH+3O2
2CO2+3H2O
难度: 简单查看答案及解析
-
已知热化学方程式2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6kJ·mol-1,则关于热化学方程式2H2O(l)=2H2(g)+O2(g) ΔH2的说法正确的是( )
A.热化学方程式中的化学计量数表示分子数
B.该反应的ΔH2大于零
C.该反应的ΔH2=-571.6kJ·mol-1
D.该反应的ΔH2可表示36 g水分解时的热效应
难度: 中等查看答案及解析