-
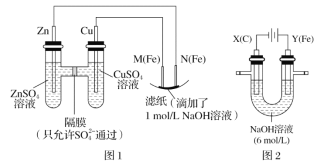
下列有关金属腐蚀与防护的说法错误的是( )
A. 钢铁在弱碱性条件下发生电化学腐蚀的正极反应式是O2+2H2O+4e-=4OH-
B. 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 中等查看答案及解析
-
荆门市积极创建全国文明城市,让城市变得“净起来、亮起来、绿起来、美起来、文明起来”,下列行为不符合文明城市创建的是( )
A.倡导市民分类回收垃圾
B.禁止焚烧秸秆,减少建筑扬尘
C.鼓励使用新能源汽车、鼓励乘坐公共交通,以减少小汽车尾气排放
D.直接排放工业废水、废气、废渣
难度: 中等查看答案及解析
-
化学用语是学习化学的工具和基础,下列有关化学用语的使用正确的是( )
A.食醋呈酸性的原因是:CH3COOH=CH3COO-+H+
B.纯碱溶液呈碱性的原因是:CO32-+2H2O
H2CO3+2OH-
C.2CH3CH2OH+O2
2CH3CHO+2H2O
D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ·mol-1
难度: 简单查看答案及解析
-
室温下,若溶液中由水电离产生的c(OH-)=1×10-13mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.ClO- Na+ NO3- Cl- B.K+ I- SO42- NO3-
C.K+ Na+ Cl- HSO3- D.K+ Na+ Cl- NO3-
难度: 中等查看答案及解析
-
铁粉与足量1 mol·L-1盐酸反应,为了加快反应速率且不影响产生氢气的量可以加入( )
①2 mol·L-1硝酸溶液 ②少量硫酸铜(s) ③少量铜粉 ④少量醋酸钠(s) ⑤对溶液加热 ⑥向反应液中通入氯化氢气体 ⑦加入过量铁粉 ⑧将铁粉改为铁片
A.②③④⑤⑥ B.③⑤⑥ C.①③⑤⑥⑦ D.③⑤⑥⑧
难度: 中等查看答案及解析
-
向0.1mol·L-1的CH3COOH溶液中加水或加入少量CH3COONa晶体时,下列有关叙述不正确的是( )
A.都能使溶液的pH增大
B.都能使溶液中c(H+)·c(CH3COO-)减小
C.都能使溶液中
比值增大
D.溶液中
不变
难度: 中等查看答案及解析
-
下列实验中,由于错误操作导致所测出的数据一定偏低的是( )
A.用标准氢氧化钠溶液滴定盐酸时,开始滴定时碱式滴定管尖嘴部分有气泡,在滴定过程中气泡消失,所测定盐酸的浓度
B.用标准盐酸滴定氢氧化钠溶液时,滴定前平视读数,达到滴定终点仰视读数,所测出的碱液的浓度
C.配制一定物质的量浓度的氢氧化钠溶液,溶解后未冷却,所配溶液的物质的量浓度
D.配制一定物质的量浓度的氯化钠溶液,定容时仰视容量瓶,所配溶液的物质的量浓度
难度: 中等查看答案及解析
-
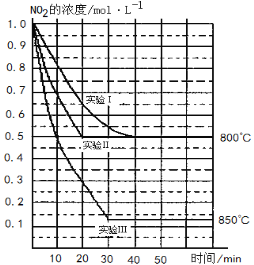
恒温恒容下的可逆反应A(g)+3B(g)
2C(g),下列叙述不是反应达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的质量分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的密度不再变化
⑦混合气体的平均相对分子质量不再变化
⑧A、B、C的分子数之比为1:3:2
A.①②⑥ B.②④⑥ C.②⑥⑧ D.③⑦⑧
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
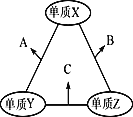
A.元素的非金属性:X>Y>Z
B.B和C中化学键类型相同
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
难度: 中等查看答案及解析
-
2019年度诺贝尔化学奖授予研究锂离子电池的三位化学家,以表彰他们在锂离子电池发展方面所做出的突出贡献。锂锰电池是一种常用的锂离子电池,它体积小、性能优良,该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2,下列说法错误的是( )
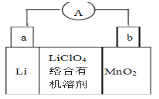
A.外电路的电流方向是由b极流向a极
B.电池正极反应式为MnO2+e-+Li+=LiMnO2
C.可用水代替电池中的混合有机溶剂
D.电路中每通过1mol电子,就有NA个Li+移向b极
难度: 中等查看答案及解析
-
中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是
A.电解精炼铜时,负极反应式:Cu2++2e-=Cu
B.氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气
C.在氯碱工业中,电解池中的阴极产生的是H2, NaOH在阳极附近产生
D.电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
难度: 中等查看答案及解析
-
一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)
pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
A. m+n>p B. m+n<p
C. 平衡向正反应方向移动 D. C的质量分数增加
难度: 中等查看答案及解析
-
aA(g)+bB(g)
cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是( )

A.a+b>c+d T1>T2 Q>0 B.a+b>c+d T1<T2 Q<0
C.a+b<c+d T1<T2 Q>0 D.a+b>c+d T1>T2 Q<0
难度: 中等查看答案及解析
-
取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25℃),则下列说法(或关系式)正确的是( )
A.c(Na+)﹣c(X-)=9.9×10-7mol/L
B.c(Na+)= c(X-)+c(HX)= 0.2mol/L
C.混合溶液中由水电离出的c(OH-)= 1×10-8mol/L
D.c(OH-)﹣c(HX)= c(H+)=1×l0-6mol/L
难度: 中等查看答案及解析
-
(下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式
AgCl
Ag2CrO4
CH3COOH
HClO
H2CO3
Ksp或Ka
Ksp=1.8×10﹣10
Ksp=9.0×10﹣12
Ka=1.8×10﹣5
Ka=3.0×10﹣8
Ka1=4.1×10﹣7
Ka2=5.6×10﹣11A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1 mol•L﹣1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10﹣3mol•L﹣1的KCl和K2CrO4混合溶液中滴加1.0×10﹣3mol•L﹣1的AgNO3溶液,CrO42﹣先形成沉淀
难度: 中等查看答案及解析