-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
已知:C(s)+ H2O(g)== CO(g) + H2(g) △H = a kJ·mol-1
2 C(s)+ O2(g)== 2CO(g) △H = -220 kJ·mol-1
H-H 、O=O和O-H键的键能(kJ·mol-1)分别为436、496和462,则a为( )
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
难度: 简单查看答案及解析
-
清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。其主要成分都是
A.碳水化合物 B.碳氢化合物 C.氢气 D.醇类
难度: 中等查看答案及解析
-
已知:①
△H1 =+180.5kJ/mol ;
②
△H2 =—221.0kJ/mol;
③
△H3 =—393.5kJ/mol
则能表示汽车尾气转化的热化学方程式为( )
A.
△H =+746.5kJ/mol
B.
△H =—746.5kJ/mol
C.
△H =—1493kJ/mol
D.
△H =+1493kJ/mol
难度: 中等查看答案及解析
-
下列说法或表示法正确的是( )
A.需要加热的反应说明它是吸热反应
B.氢气与氧气反应生成等量的水蒸气和液态水,前者放出的热量多
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l),ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1.1 mol NaOH的稀溶液混合,放出的热量等于 57.3 kJ
D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2=SO2 ΔH=-297.3 kJ/mol
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
难度: 中等查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
难度: 中等查看答案及解析
-
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa
体积分数/%
温度/℃
1.0
2.0
3.0
810
54.0
a
b
915
c
75.0
d
1000
e
f
83.0
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
难度: 中等查看答案及解析
-
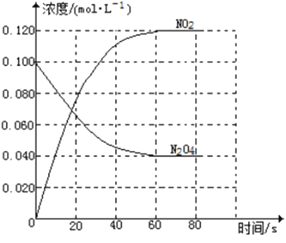
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
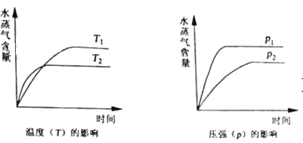
A.CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)
CO(g)+H2O(g);△H>0
C.CH3CH2OH (g)
CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)
2 C6H5CH=CH2(g)+2H2O(g);△H<0
难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq) + I-(aq)
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应 I2(aq) + I-(aq)
I3-(aq)的△H>0
B.状态A与状态B相比,状态A的c(I2)大
C.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
D.若反应进行到状态D时,一定有v正>v逆
难度: 中等查看答案及解析
-
温度为25℃时,将0.23 g钠投入到100g水中充分反应,假设反应后溶液体积为100mL,则该溶液的pH为
A.1 B.13 C.12 D.10
难度: 中等查看答案及解析
-
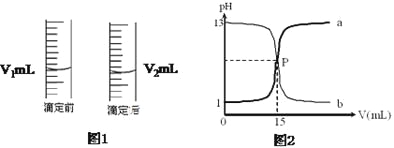
H2S2O3是一种弱酸,实验室欲用0.01mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
A.该滴定可用甲基橙作指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用如图所示装置
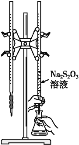
D.该反应中每生成1molNaI,电子转移数为2NA
难度: 中等查看答案及解析
-
在由水电离出来的c (H+)=1×10-13 mol·L-1溶液中,下列离子可能大量共存的是( )
A.NH4+、Ba2+、NO3-、CO32- B.Fe2+、Na+、SO42-、MnO4-
C.K+、Mg2+、NO3-、SO42- D.Na+、Fe3+、Cl-、AlO2-
难度: 简单查看答案及解析
-
物质的量浓度相同的三种溶液:①氯化铵、②氨水、③硫酸氢铵,c(NH4+)大小顺序正确的是
A.①>②>③ B.③>②>① C.②>③>① D.③>①>②
难度: 简单查看答案及解析
-
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
难度: 简单查看答案及解析
-
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
难度: 中等查看答案及解析
-
下列溶液中物质的量浓度关系正确的是
A.室温,0.1mol·L-1的 CH3COOH 溶液中:c(CH3COOH) < c(CH3COO-)
B.1L 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液中:c(SO42-)> c(NH4+)> c(Fe2+)> c(H+)> c(OH-)
C.室温,0.1 mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液,pH大小的顺序为:NaOH<CH3COONa< Na2CO3
D.向0.01 mol·L-1的NaHSO4溶液中滴加NaOH溶液至中性时:c(SO42-) > c(Na+) > c(OH-)= c(H+)
难度: 中等查看答案及解析
-
25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法错误的是( )
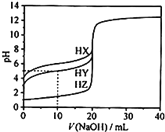
A.HZ是强酸,HX、HY是弱酸
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.向上述HY溶液中滴加任意NaOH溶液时,均存在c(H+)+c(Na+)=c(OH-)+c(Y-)
难度: 中等查看答案及解析