-
下列诗句描述的景象中,含有光合作用这种化学变化的是
A.黑云翻墨未遮山
B.山色空蒙雨亦奇
C.奇峰历历云如画
D.画栏桂树悬秋香
难度: 简单查看答案及解析
-
低碳生活既是一种生活方式,同时更是一种可持续发展的环保责任。低碳生活要求人们树立全新的生活观和消费观,减少碳排放,促进人与自然和谐发展。下列做法中,不.符.合.低碳生活的是
A.夏天室内空调温度越低越好
B.严禁麦收后露天焚烧小麦秸秆
C.回收金属制品避免材料浪费
D.乘坐公共交通工具少开私家车
难度: 简单查看答案及解析
-
饮食健康是大家非常关心的话题。下列做法中,对人体无.害.的是
A.用化工染料浸泡包粽子的竹叶
B.炒菜煲汤时放入适量食盐
C.种植蔬菜时喷洒剧毒农药杀虫
D.过期糕点重加工后再食用
难度: 简单查看答案及解析
-
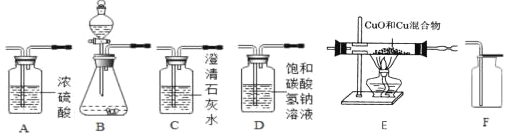
实验是学习化学的一条重要途径,下列化学实验操作错误的是( )
A.
气密性的检查 B.
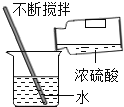 浓硫酸的稀释
浓硫酸的稀释C.
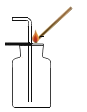 二氧化碳的验满 D.
二氧化碳的验满 D. D液体的量取
难度: 简单查看答案及解析
-
了解化学安全知识,增强安全防范意识。下列做法不符合安全要求的是
A.室内电器着火,先切断电源再灭火
B.森林发生火灾时,可砍掉部分树木形成隔离带
C.厨房天然气泄露,可打开抽油烟机排气
D.炒菜时油锅着火,立即盖上锅盖
难度: 简单查看答案及解析
-
如图为 M 元素的原子结构示意图。下列说法错误的是

A.x 值为 11
B.M 元素属于金属元素
C.M 元素的化学性质与最外层电子数密切相关
D.M 元素的原子在反应中易失电子,形成 M-
难度: 简单查看答案及解析
-
用分子的知识解释下列现象,其中合理的是
A.水结成冰,是因为温度降低,分子停止运动,静止了
B.冰和干冰的化学性质存在差异,因为构成它们的分子不同
C.水烧开后易把壶盖顶起,是因为温度升高,分子变大
D.H2O在通电条件下产生H2,因为H2O分子中存在H2
难度: 简单查看答案及解析
-
玻璃工艺如今做的越来越精美,如图所示是一漂亮的玻璃灯罩。在玻璃雕刻过程中用到的是氢氟酸(化学式 HF),发生的反应为
。下列说法正确的是

A.X的化学式为 H2O
B.玻璃是一种金属材料
C.SiO2 中 Si 的化合价为+2 价
D.硅是地壳中含量最高的非金属元素
难度: 简单查看答案及解析
-
下列说法中,不正确的是
A.不能用铁桶盛放农药波尔多液
B.可用熟石灰处理含酸量超标的污水
C.工业上利用液氮和液氧的密度不同制取氧气
D.胃酸过多可服用碱性药物,以减轻胃部不适
难度: 中等查看答案及解析
-
类推是化学学习中常用的思维方法。以下类推结果中正确的是
A.金属铝与盐酸反应生成 AlCl3 和 H2,则铁与盐酸反应生成 FeCl3 和 H2
B.由不同种元素组成的纯净物是化合物,则化合物中至少含两种元素
C.催化剂可以加快化学反应速率,所以任何化学反应都需要催化剂
D.燃烧一般都伴随发光、放热现象,所以有发光、放热现象的变化就是燃烧
难度: 中等查看答案及解析