-
废弃的电池已成为重要的环境污染物,有资料表明一节废弃的镍镉电池可使1 m2面积的耕地失去使用价值,因此废旧电池必须集中回收处理,主要原因是( )
A. 回收其中的电极
B. 利用电池外壳的金属材料
C. 不使电池中渗出的电解液腐蚀其他物品
D. 防止电极中汞、镉、镍和铅等重金属离子对土壤和水源造成污染
难度: 中等查看答案及解析
-
下列变化过程需要吸收热量的是
A. 铝热反应 B. 木炭燃烧 C. 干冰升华 D. 稀释浓硫酸
难度: 简单查看答案及解析
-
对S、Cl两种元素,以下说法错误的是( )
A. 非金属性:S < Cl B. 离子半径:S2- < Cl-
C. 气态氢化物稳定性:H2S < HCl D. 单质氧化性:S < Cl2
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法一定正确的是( )
A. 22.4L SO2含有的分子数为NA
B. 常温常压下,16g O3含有的氧原子数为NA
C. 1molMg变成Mg2+时,失去电子的数目为NA
D. 1L 1mol·L-1H2SO4溶液中含H+的数目为NA
难度: 简单查看答案及解析
-
创立元素周期表的化学家是
A. 牛顿 B. 阿伏加德罗 C. 门捷列夫 D. 道尔顿
难度: 简单查看答案及解析
-
金属性最强的元素是
A. Li B. Na C. K D. Mg
难度: 简单查看答案及解析
-
下列物质的分离原理与溶解度有关的是
A. 蒸馏 B. 过滤 C. 升华 D. 萃取
难度: 简单查看答案及解析
-
在NO2被水吸收的反应中,发生还原反应和氧化反应的NO2的物质的量之比为( )
A. 3:1 B. 1:3 C. 1:2 D. 2:1
难度: 简单查看答案及解析
-
lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+1/2O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. Al2O3熔点高,可用作耐高温材料
B. SO2具有氧化性,可用于漂白纸浆
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 简单查看答案及解析
-
下列气体中,不会造成空气污染的是( )
A.N2 B.NO C.NO2 D.SO2
难度: 简单查看答案及解析
-
下列气体中不能用排空气法收集的是( )
A.H2 B.CO2 C.NO D.O2
难度: 简单查看答案及解析
-
如图是元素周期表中的一格,从该图获取的信息有错误的是

A. 该元素在地壳中的含量为35.45%
B. 该元素的元素符号为Cl
C. 该元素的原子序数为17
D. 该元素的名称是氯
难度: 简单查看答案及解析
-
下列物质中,既有离子键又有共价键的是( )
A.MgCl2 B.NH3 C.NH4Cl D.H2O2
难度: 简单查看答案及解析
-
太空探索器常用
制成的核电池提供动力,该核素的中子数为( )
A.144 B.238 C.332 D.94
难度: 简单查看答案及解析
-
下列各组物质的性质比较中,正确的是( )
A. 还原性:
B. 稳定性:
C. 酸性:
D. 碱性:
难度: 中等查看答案及解析
-
下列金属的冶炼方法中,属于热还原法的是( )
A.2Ag2O
4Ag+O2↑ B.Fe+CuSO4=FeSO4+Cu
C.Fe2O3+3CO
2Fe+3CO2 D.MgCl2(熔融)
Mg+Cl2↑
难度: 简单查看答案及解析
-
实验室从干海带中提取碘的操作过程中,仪器选用错误的是( )
A.称取一定质量的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤海带灰水混合物——漏斗
D.在海带灰浸取液中加入适量氯水后,用四氯化碳提取碘——分液漏斗
难度: 简单查看答案及解析
-
水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是( )
A.过滤法 B.蒸馏法 C.分液法 D.冰冻法
难度: 简单查看答案及解析
-
能源问题是当今世界发展的一个主要问题。下列能源符合“绿色化学”的概念的是
A.氢气 B.煤 C.沼气 D.石油
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.燃烧、酸碱中和反应都是放热反应
B.化学反应必然伴随着能量的变化
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
难度: 中等查看答案及解析
-
根据下图提供的信息,下列所得结论正确的是( )
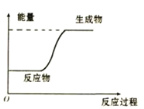
A.该反应为放热反应
B.该图可以表示铝热反应
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热
难度: 中等查看答案及解析
-
工业合成氨的反应为N2(g)+3H2(g)
2NH3(g),已知下列化学键的键能:
化学键
键能kJ/mol
H-H
436
N-H
391
N
N
946
下列说法正确的是
A. 该反应为吸热反应 B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1 D. 生成1 mol NH3放出92 kJ热量
难度: 中等查看答案及解析
-
氢气燃烧生成液态水,放出
热量。下列热化学方程式正确的是
A.
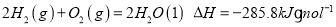
B.
C.
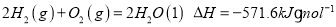
D.

难度: 中等查看答案及解析
-
使用绿色能源有利于保护环境。下列能源中不属于绿色能源的是
A.太阳能 B.地热能 C.风能 D.煤
难度: 简单查看答案及解析