-
磁山(在今河北省邯郸市武安)是我国四大发明之一指南针的发源地。据《古矿录》记载:《明史地理志》称:“磁州武安县西南有磁山,产磁铁石。”文中的磁铁石的主要化学成分应该是( )
A.Fe2O3 B.FeO C.Fe3O4 D.Fe(OH)3
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.酒精的浓度越大其消毒杀菌的效果越好
B.人体需要的各种微量元素必须通过保健食品进行补充
C.谷氨酸钠主要是以石油或煤为原料合成的化工产品
D.淀粉等糖类物质是人体需要能量的主要来源
难度: 简单查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[2,3]己烷的结构为
,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
A.
的名称为螺[4,3]辛烷
B.
的所有碳原子处于一个平面
C.螺[2,3]己烷是己烯的同分异构体
D.螺[2,3]己烷加氢可能生成己烷
难度: 中等查看答案及解析
-
下列实验方法中正确的是( )
A.铜的精炼
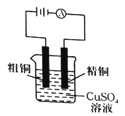
B.除去乙烷中的乙烯
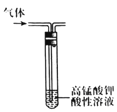
C.稀释浓硫酸
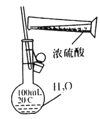
D.制备乙酸乙酯
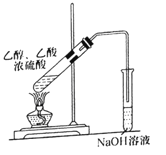
难度: 简单查看答案及解析
-
碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是( )
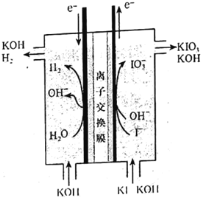
A.其阳极反应式是I-+3H2O-6e-=IO
+6H+
B.该工业过程中KOH是循环利用的物质
C.制得21.4gKIO3产生标况下H26.72L
D.该工业过程使用阳离子交换膜
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
常温下将铝块放入浓硝酸中
无明显现象发生
铝常温下与浓硝酸不反应
B
切开金属钠,观察其断面的变化
断面逐渐失去光泽
原因是生成了Na2O2
C
将Cl2和H2S气体在集气瓶中混合观察现象
瓶壁上出现黄色固体
Cl2氧化性比S强
D
在试管中加入少量苯,再加入溴水,振荡观察现象
水层呈无色
苯与溴发生取代反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,在周期表中Y和Z处于同一主族,X和Y、Z和W处于相邻位置。W的原子最外层和K层的电子数之差等于X元素原子的最外层电子数,Y元素可以分别与另外三种元素同时存在于多种常见酸中。则下列说法中正确的是( )
A.Z对应的酸性氧化物只有一种
B.W单质水溶液比单质状态时氧化能力更强
C.X、Y的简单氢化物的混合物中分子和离子共有5种
D.最高价氧化物对应水化物的酸性W的比Z弱
难度: 中等查看答案及解析

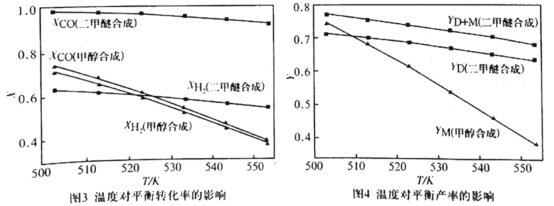

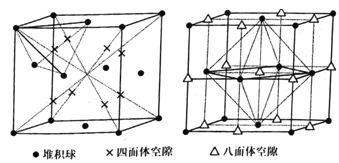
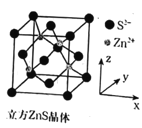
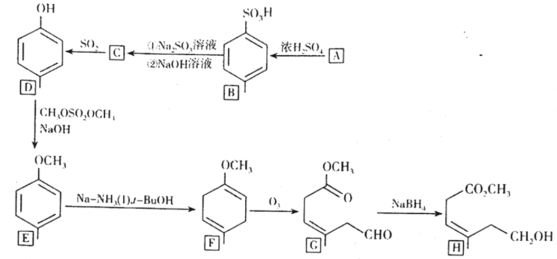
 ,请结合题中信息设计由
,请结合题中信息设计由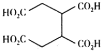 的合成路线(其他试剂任选):___。
的合成路线(其他试剂任选):___。