-
化学与科技、社会、生活有着密切的联系。下列有关说法正确的是( )
A.N95口罩的原材料聚丙烯是一种天然有机高分子化合物
B.汉代烧制的“明如镜、声如磬”的瓷器,其主要原料为黏土
C.利用酒精的强氧化性可以灭活新型冠状病毒
D.“纷纷灿烂如星陨,㸌㸌喧豗似火攻”描述了钠、铁等金属的焰色反应
难度: 简单查看答案及解析
-
下列有关仪器的使用方法或实验操作正确的是( )
A.用坩埚灼烧干海带制海带灰
B.蒸馏时,温度计水银球插入液面以下
C.用长颈漏斗分离CCl4萃取碘后的水层与有机层
D.用容量瓶配制溶液时,若加水超过刻度线,用胶头滴管吸出多余液体
难度: 简单查看答案及解析
-
下列化合物中不能发生加成反应的是( )
A.甲苯 B.乙烯 C.丙炔 D.丁烷
难度: 简单查看答案及解析
-
均为短周期主族元素,三种元素位于同一周期,
两元素的最外层电子数之和与Z的最外层电子数相等,Y的最外层电子数是内层电子数的3倍。下列说法正确的是( )
A.原子半径:
B.最简单氢化物的热稳定性:
C.XZ为共价化合物 D.
的单质均不能与水发生反应
难度: 简单查看答案及解析
-
设
为阿伏加德罗常数的值。下列叙述正确的是( )
A.
难溶于稀硫酸,也难溶于稀醋酸
B.常温下,
的
溶液中的离子总数为
C.常温下,
的溶液中可能大量存在
、
、
、
D.在
稀溶液中,
难度: 中等查看答案及解析
-
CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
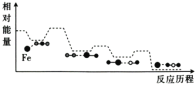
下列叙述错误的是( )
A.Fe*是反应的催化剂
B.两步反应的ΔH均小于0
C.第一步反应比第二步反应快
D.总反应为CO+N2O=N2+CO2
难度: 简单查看答案及解析
-
我国科学家发明了一种“可固氮”的镁-氮二次电池,其装置如图所示,下列说法不正确的是( )
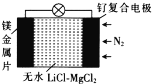
A.固氮时,电池的总反应为3Mg+N2=Mg3N2
B.脱氮时,钌复合电极的电极反应式为Mg3N2-6e-=3Mg2++N2
C.固氮时,外电路中电子由钌复合电极流向镁电极
D.当无水LiCl—MgCl2混合物受热熔融后电池才能工作
难度: 中等查看答案及解析
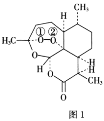
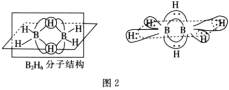
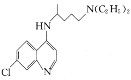 )可用于治疗新冠肺炎,氯喹的合成方法如图:
)可用于治疗新冠肺炎,氯喹的合成方法如图: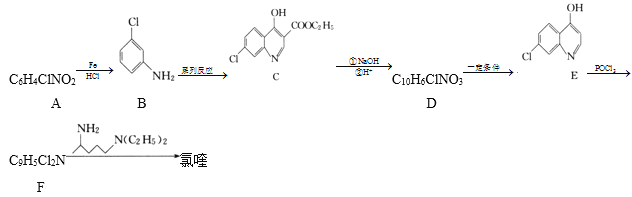
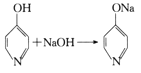 +H2O。
+H2O。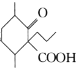 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。