-
下列物质属于原子晶体的是( )
A. 熔点是1070℃,易溶于水,水溶液能导电
B. 熔点是10.31℃,液态不导电,水溶液能导电
C. 不溶于水,熔点3550℃,不导电
D. 熔点是97.80℃,质软、导电,密度是0.97g•cm-3.
难度: 中等查看答案及解析
-
为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是
A. NH4HCO3 B. NH4Cl C. (NH4)2CO3 D. NH4NO3
难度: 中等查看答案及解析
-
下列化合物中含有共价键的是( )
A.HCl B.Na2O C.KBr D.MgCl2
难度: 中等查看答案及解析
-
化学反应常伴随着颜色变化,下列现象描述不正确的是( )
A.无色一氧化氮气体与空气接触变为红棕色
B.往盐酸中滴加紫色石蕊试液,溶液变红色
C.向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀
D.将足量二氧化硫气体通入品红溶液,红色逐渐褪去
难度: 中等查看答案及解析
-
2015年底联合国气候变化大会在巴黎召开,签署了《巴黎协定》。该协定要求各国采取更有效的“节能减排”措施控制温室效应。下列做法不利于“节能减排”的是( )
A.减少使用化石燃料 B.大力发展火力发电
C.改变能源结构,开发使用清洁能源 D.将煤气化或液化,以提高其综合利用率
难度: 简单查看答案及解析
-
下列物质中,在相同条件下最易与氢气化合的是( )
A.F2 B.Cl2 C.Br2 D.I2
难度: 简单查看答案及解析
-
朝核问题是目前全球关注的热点,已知
是一种重要的核工业原料,下列有关
说法正确的是
A.
原子核中含有92个中子 B.
原子核外有143个电子
C.
与
互为同位素 D.
的摩尔质量为235
难度: 简单查看答案及解析
-
某元素气态氢化物的化学式为H2X,则此元素最高价氧化物对应的水化物的化学式应是
A.H2XO3 B.H2XO4 C.H3XO4 D.HXO4
难度: 简单查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
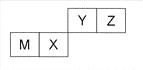
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第二周期、第ⅥA族
难度: 中等查看答案及解析
-
下图是氯化钠晶体和二氧化碳晶体的结构示意图,关于两种晶体说法正确的是
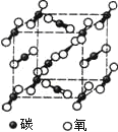
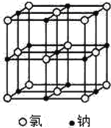
A.两种晶体内均含有共价键 B.构成两种晶体的微粒均是原子
C.两种晶体均属于离子晶体 D.两者的硬度、熔沸点差别较大
难度: 简单查看答案及解析
-
下列互为同分异构体的是( )
A.O2 和O3
B.
和
C.CH4 和CH3CH3
D.CH3CH2CH2CH3和
难度: 中等查看答案及解析
-
在水溶液中能大量共存的离子组是
A.K+、Cl-、NO3- B.Al3+、OH-、SO42-
C.H+、Na+、HCO3- D.NH4+、Ca2+、CO32-
难度: 中等查看答案及解析
-
下列实验操作错误的是
A.稀释浓硫酸时,将水沿器壁慢慢注入酸中
B.点燃氢气前,先检验氢气的纯度
C.加热液体时,试管口不对着人
D.利用丁达尔效应区别胶体和溶液
难度: 简单查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.仅由非金属元素组成的化合物可以是离子化合物
B.普通陶瓷、玻璃、水泥是使用量大的材料,其生产都采用含硅元素的原料
C.MgO的熔点很高,可用于制作耐高温材料
D.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
难度: 中等查看答案及解析
-
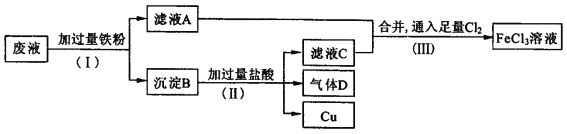
下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③ C.只有①②③ D.全部
难度: 简单查看答案及解析
-
反应3NO2+H2O=2HNO3+NO中,被氧化的物质与被还原的物质的物质的量之比为
A.1∶1 B.1∶2 C.2∶1 D.3∶1
难度: 简单查看答案及解析