-
下列属于电解质,且水溶液显碱性的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列属于置换反应,且氧化剂与还原剂的物质的量之比为2∶1的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列物质的名称不正确的是
A.NaHCO3:小苏打 B.BaCO3:重晶石
C.H2NCH2COOH:甘氨酸 D.
 :2-甲基戊烷
:2-甲基戊烷难度: 简单查看答案及解析
-
下列表示正确的是
A.中子数为10的氧原子:
B.CCl4的比例模型:

C.
的结构示意图:
 D.
D.的结构简式:
难度: 简单查看答案及解析
-
下列说法正确的是
A.
和
互为同位素 B.石英与水晶互为同素异形体
C.淀粉和纤维素互为同分异构体 D.乙酸和硬脂酸互为同系物
难度: 简单查看答案及解析
-
化学与生活、社会密切相关,下列说法正确的是
A.高锰酸钾溶液、“84”消毒液、酒精能用于杀菌消毒,都利用了强氧化性
B.将矿物燃料脱硫脱硝可有效防止酸雨
C.新型冠状病毒有可能在空气中以气溶胶的形式传播,气溶胶不属于胶体
D.以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
难度: 简单查看答案及解析
-
下列说法不正确的是
A.在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2与过量氨水反应得到
D.无水CoCl2吸水会变为蓝色,可用于判断变色硅胶是否吸水
难度: 简单查看答案及解析
-
下列说法不正确的是
A.石油裂解气能使溴水褪色
B.可利用生活垃圾中的生物质能焚烧发电
C.水煤气既可用来合成液态烃,也可以用来合成甲醇等含氧有机物
D.煤中含有苯和二甲苯等物质,可通过煤的干馏获得
难度: 简单查看答案及解析
-
下列有关实验的说法,正确的是
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.纸层析点样所用的试剂的浓度应较小,点样时的试剂斑点直径应小于0.5cm
C.用标准HCl溶液滴定未知浓度NaHCO3溶液时可选择甲基橙为指示剂
D.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
难度: 简单查看答案及解析
-
下列关于氮及其化合物的说法,不正确的是
A.铵盐一般都溶于水,且都可分解放出氨气
B.液氨气化时会吸收大量的热,所以NH3可用作制冷剂
C.汽车尾气中的氮氧化物是造成光化学烟雾的主要原因之一
D.工业浓硝酸通常呈黄色,是因为溶解了NO2气体
难度: 简单查看答案及解析
-
不能正确表示下列变化的离子方程式是
A.用醋酸除去水垢:
B.用氢氧化钠溶液除去镁粉中的杂质铝:
C.室温下,测得小苏打溶液pH>7,证明碳酸是弱酸:
D.将
溶液与0.40mol·L-1NaOH溶液等体积混合:
难度: 中等查看答案及解析
-
下列说法正确的是
A.可用丁达尔效应区分淀粉溶液和氢氧化铁胶体
B.油脂在碱性条件下生成高级脂肪酸盐和甘油的反应称为皂化反应
C.溴苯中混有溴,加入KI溶液,振荡,然后用汽油萃取除去碘
D.在鸡蛋清溶液中分别加入饱和硫酸铵溶液、硫酸铜溶液,都会有沉淀析出,继续加水,又都会重新溶解
难度: 简单查看答案及解析
-
某有机物X的结构简式如图所示,下列关于X的说法不正确的是

A.X分子中含有四种官能团
B.X能与金属钠反应,且相同条件下比水与金属钠反应要剧烈
C.1molX最多与5mol氢气发生加成反应
D.在一定条件下,X能发生加成、取代、加聚、缩聚、氧化、还原等反应
难度: 中等查看答案及解析
-
下列说法不正确的是
A.离子半径(r):
B.若存在简单阴离子
,则X一定属于第ⅦA族元素
C.S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D.元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
难度: 中等查看答案及解析
-
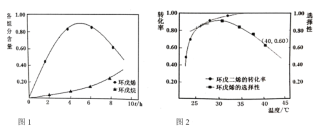
某温度下,HF和CH3COOH的电离常数分别为3.5×10-4和1.7×10-5。将pH和体积均相同的NaF和CH3COONa溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
A.曲线I代表CH3COONa溶液
B.溶液中水的电离程度:c点>b点
C.从b点到d点,溶液中
保持不变(其中HA、
分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与HCl恰好反应后,溶液中
相同
难度: 困难查看答案及解析
-
电化学原理在化学工业中有广泛的应用。根据如下工作原理图,下列说法正确的是

A.电极Y为正极,电极反应式为:
B.若W为饱和食盐水(滴有几滴酚酞溶液),则工作一段时间后a电极附近溶液变红
C.若a为粗铜(含Zn、Ag等杂质),W为CuSO4溶液,工作一段时间后
减小
D.若a为银棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16g,则X电极消耗氢气0.224L
难度: 中等查看答案及解析
-
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应的能量变化如图所示。下列说法正确的是
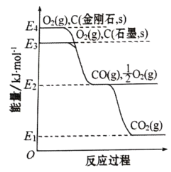
A.在通常状况下,金刚石比石墨更稳定
B.石墨的燃烧热为
C.
D.12g石墨在一定量的空气中燃烧,生成气体产物36g,该过程放出的热量为
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
B.含NA个Na+的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1mol·L-1
C.在
反应中,每生成32g氧气,则转移2NA个电子
D.常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含
物质的量相同
难度: 中等查看答案及解析
-
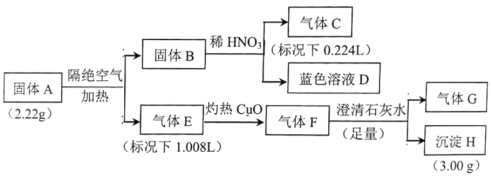
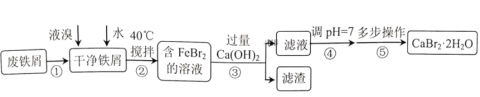
已知:
;将汽车尾气中的CO和NO气体转化CO2和N2是减少汽车尾气的有效途径之一,若用
、
、
、
分别表示CO、NO、CO2、N2,在固体催化剂表面,上述反应的过程可用图表示,下列说法正确的是

A.从吸附到解吸的过程中,能量状态最低的是C处
B.图示过程中,反应物断键吸收能量大于生成物形成所释放的能量
C.该反应的反应物浓度越大,反应速率一定越快
D.该反应中的固体催化剂起到反应载体的作用,未影响反应的速率
难度: 中等查看答案及解析
-
T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min
0
10
20
30
40
0.80
0.60
0.48
0.00
0.20
0.40
0.40
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为
C.保持其他条件不变,升高温度,平衡时,
,则
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
难度: 中等查看答案及解析
-
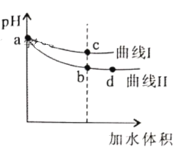
室温下,用相同浓度的NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的三种酸(HA、HB和HC)溶液,滴定的曲线如图所示,下列判断不正确的是
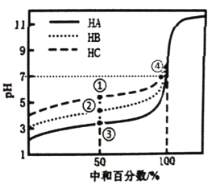
A.当中和百分数达50%时:
B.滴定至①点时,溶液中:
C.当中和百分数达100%时,消耗的NaOH溶液体积
D.①和④所示溶液中都有:
难度: 困难查看答案及解析
-
已知:BF3和水反应生成氟硼酸(HBF4)和硼酸(H3BO3),一定条件下BF3与一定量水可形成
晶体Q(
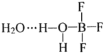 )。下列有关说法,正确的是
)。下列有关说法,正确的是A.BF3和水反应生成氟硼酸和硼酸是氧化还原反应
B.BF3分子中,每个原子的最外层都具有8电子稳定结构
C.晶体Q中存在离子键、共价键、范德华力和氢键
D.H3BO3在水中只发生反应:
,可知硼酸是一元酸
难度: 中等查看答案及解析
-
下列化合物中既有离子键又有共价键的化合物是
A.H2O2 B.Na2O C.NH4Cl D.Mg3N2
难度: 简单查看答案及解析
-
配制0.1mol·L-1NaCl溶液不需要用到的仪器是


A
B
C
D
A.A B.B C.C D.D
难度: 简单查看答案及解析