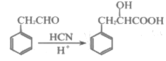
-
中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是( )
A.《周礼》中记载沿海古人“煤饼烧蛎房成灰”,“灰”的主要成分是CaO
B.刘禹锡《浪淘沙》诗句“千淘万漉虽辛苦,吹尽黄沙始到金。”“淘”、“漉”相当于分离提纯操作中的“过滤”
C.《天工开物》有言“世间丝、麻、裘、褐皆具素质”,“丝、麻”的主要成分都是蛋白质
D.《本草经集注》记载“以火烧之,紫青烟起,云是真硝石(硝酸钾)也”,钾的焰色反应为紫色
难度: 简单查看答案及解析
-
我国有较多的科研人员在研究甲醛的氧化,有人提出HCHO(
)与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。
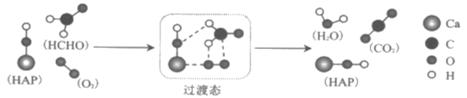
下列说法正确的是( )
A.该反应的氧化产物是CO2
B.HCHO在反应过程中有C=O键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.HAP能提高HCHO与O2应的活化能,但不改变反应路径
难度: 中等查看答案及解析
-
下列四有机物存在如图所示的转化关系,有关说法错误的是( )
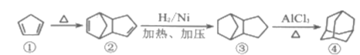
A.有机物①最多有9个原子共平面
B.有机物②可以发生取代反应、加成反应和加聚反应
C.有机物③和有机物④互为同分异构体
D.有机物①②③④都能使酸性KMnO4溶液褪色,都有漂白性
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B.100g46%的甲酸(HCOOH)水溶液中所含的氧原子数目为5NA
C.lmol铁粉高温下与足量水蒸气反应,转移电子数为3NA
D.2molSO2和lmolO2在催化剂作用下充分反应所得分子总数为2NA
难度: 中等查看答案及解析
-
下列提供的仪器和试剂,能达到实验目的的是( )
实验
仪器
试剂
实验目的
A
烧杯、试管、滴管
待测液、BaCl2溶液、稀HNO3
检验待测液中是否含SO42-
B
试管2支、铁架台
醋酸、乙醇、饱和碳酸钠溶液
实验室制乙酸乙酯
C
大烧杯、小烧杯、量筒2个、泡沫塑料、硬纸板
0.50mol/L盐酸、0.55mol/LNaOH溶液
测定中和反应的反应热
D
pH计、酸式滴定管、碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台
0.l000mol/LHCl溶液、0.l000mol/LNaOH溶液、酚酞溶液、蒸馏水
测定酸碱滴定曲线
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
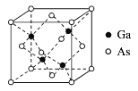
有X、Y、W、M四种短周期主族元素,其原子序数依次增大,Y的原子半径是所有短周期主族元素中最大的,X的核外电子数与Y、M的最外层电子数之和相等,W的原子序数是M的最外层电子数的2倍,由X、Y、W三种元素形成的化合物G的结构如图所示。下列叙述不正确的是( )
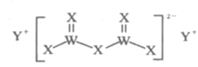
A.常见X的单质在常温下一定是气体
B.X、W的简单氢化物稳定性:X>W
C.单质Y与氧气反应的产物一定呈淡黄色
D.化合物G中X都满足8电子稳定结构
难度: 困难查看答案及解析
-
国际社会高度赞扬中国在应对新冠肺炎疫情时所采取的措施。疫情防控中要对环境进行彻底消毒,二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的是( )
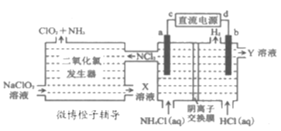
A.c为电源的负极,在b极区流出的Y溶液是浓盐酸
B.电解池a极上发生的电极反应为NH4+-6e-+3Cl-=NCl3+4H+
C.二氧化氯发生器内,发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为6:1
D.当有0.3mol阴离子通过离子交换膜时,二氧化氯发生器中产生1.12LNH3
难度: 中等查看答案及解析
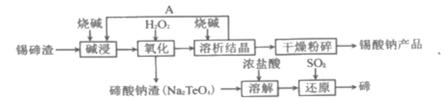
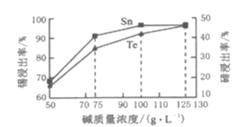
 ②
②