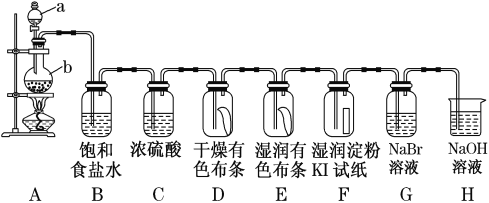
-
某无色溶液中,可大量共存的离子组是( )
A.Na+、HCO3-、SO42-、Br-
B.Cu2+、NO3-、Cl-、SO42-
C.H+、Cl-、K+、CO32-
D.K+、Mg2+、SO42-、OH-
难度: 简单查看答案及解析
-
下列溶液中的氯离子浓度与50mL1mol·L-1的AlCl3溶液中氯离子浓度相等的是( )
A.150mL1mol·L-1的NaCl B.75mL2mol·L-1的NH4Cl
C.150mL3mol·L-1的KCl D.75mL2mol·L-1的CaCl2
难度: 简单查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH<Mg(OH)2<Al(OH)3 B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al D.还原性:Na>Mg>Al
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数为1NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,1NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA
难度: 简单查看答案及解析
-
既能用浓硫酸干燥又能用碱石灰干燥的气体是( )
A.Cl2 B.CO2 C.O2 D.NH3
难度: 中等查看答案及解析
-
下列化合物中,既有离子键又有共价键的是
A.NH4Cl B.MgO C.C2H6 D.CO2
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应:CO32- + 2H+ = CO2↑+ H2O
B.硫酸和氯化钡溶液反应:Ba2+ + SO42- = BaSO4↓
C.铜片插入硝酸银溶液中:Cu + Ag+ = Ag + Cu2+
D.铁钉放入硫酸铜溶液中:Fe + 3Cu2+ = 2Fe3+ + 3Cu
难度: 简单查看答案及解析
-
往下列溶液中加入足量NaOH溶液,充分反应后,不会出现沉淀的是( )
A.MgCl2溶液 B.AlCl3溶液 C.CaCl2溶液 D.FeCl3溶液
难度: 简单查看答案及解析
-
下列表述Ⅰ、Ⅱ均正确并且无因果关系的是( )
选项
表述Ⅰ
表述Ⅱ
A
常温下铝在浓硫酸中发生钝化
可用铝槽车密封运送浓硫酸
B
SO2有漂白性
SO2通入品红溶液中,溶液褪色
C
热稳定性:Na2CO3>NaHCO3
同浓度溶液碱性:Na2CO3>NaHCO3
D
非金属性:F>Cl
氢化物的稳定性:HF>HCl
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO32ˉ+H2O
HCO3ˉ+OHˉ。下列说法正确的是
A.稀释溶液,上述可逆反应平衡常数不变 B.通入CO2,溶液pH增大
C.加入NaOH固体,平衡向正反应方向移动 D.升高温度,
不变
难度: 中等查看答案及解析
-
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
难度: 简单查看答案及解析
-
室温下,0.1 mol·L-1的氨水中,下列关系式中不正确的是( )
A.c(OH-)>c(H+)
B.c(NH3·H2O)+c(NH4+)=0.1 mol·L-1
C.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D.c(OH-)=c(NH4+)+c(H+)
难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)⇌A2(g)+3B2(g) △H>0 ,下列图像正确的( )
A.
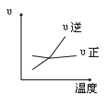 B.
B.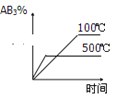
C.
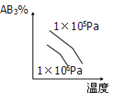 D.
D.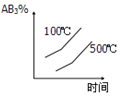
难度: 中等查看答案及解析
-
下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体
D.过量的铁丝在氯气中点燃,可制取氯化亚铁
难度: 中等查看答案及解析
-
下列有关钠的叙述正确的是( )
①钠在空气中燃烧生成氧化钠
②金属钠可以保存在煤油中
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠有强还原性
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④ B.②③⑤ C.①④⑤ D.②④⑤
难度: 中等查看答案及解析
-
用铝箔包装0.1mol的金属钠,用针刺一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为( )
A.O2和H2的混合气体 B.1.12L H2 C.大于1.12L H2 D.小于1.12L气体
难度: 中等查看答案及解析
-
下列关于某些氧化物的说法正确的是( )
A.NO2、Na2O2都能与水发生氧化还原反应
B.NO、CO2均可用向上排空气法收集
C.CO2、SO2可用澄清石灰水鉴别
D.CO2、SO3都可由相应单质在O2中燃烧生成
难度: 中等查看答案及解析
-
据以下判断Cu2+、Fe2+、Fe3+的氧化性,从强到弱的顺序为( )
① Fe + CuCl2= FeCl2+ Cu
② 2FeCl3+ Cu = 2FeCl2+ CuCl2
A.Fe3+>Fe2+>Cu2+ B.Fe3+>Cu2+>Fe2+
C.Fe2+>Cu2+>Fe3+ D.Cu2+>Fe2+>Fe3+
难度: 简单查看答案及解析
-
下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Si 1s22s22p2
难度: 简单查看答案及解析