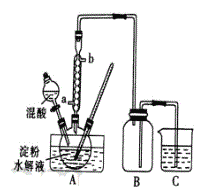
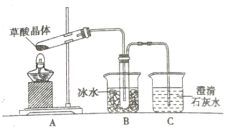
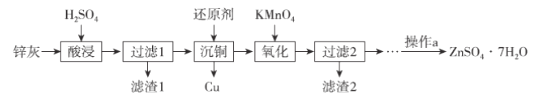
-
分子式为C10H14的有机物,苯环上只有两个取代基的同分异构体有多少种(不考虑立体异构)
A.3种 B.6种 C.9种 D.12种
难度: 简单查看答案及解析
-
化学与人类生活、社会可持续发展密切相关,下列说法错误的是( )
A.新型冠状病毒主要由C、H、O、N、S等元素组成,常用质量分数为75%的医用酒精杀灭新型冠状病毒
B.葡萄中含有的花青素在碱性环境下显蓝色,可用苏打粉检验假葡萄酒
C.植物油长期露置在空气中会因发生氧化反应而变质
D.防疫时期很多家庭都备有水银温度计,若不慎打破,应立即用硫磺粉末覆盖
难度: 中等查看答案及解析
-
下列物质能发生消去反应,但不能发生催化氧化的是( )
A.
 B.(CH3)2CHOH
B.(CH3)2CHOHC.CH3CH2C(CH3)2CH2OH D.CH3CH2C(CH3)2OH
难度: 中等查看答案及解析
-
用丙醛(CH3-CH2-CHO)制取聚丙烯
的过程中发生的反应类型为( )
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原
A.①④⑥ B.⑤②③ C.⑥②③ D.②④⑤
难度: 中等查看答案及解析
-
迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如右图所示。下列叙述正确的是
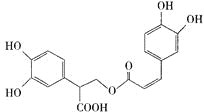
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、消去、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗8mol H2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
难度: 中等查看答案及解析
-
某有机物分子的结构简式如图所示,下列相关叙述正确的是( )
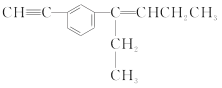
A.该有机化合物含有3种官能团
B.该有机物分子中最多有12个碳原子在同一平面内
C.该有机物分子中最多有6个碳原子共线
D.该有机物分子中最多有14个碳原子在同一平面内
难度: 中等查看答案及解析
-
下列化学方程式或离子方程式正确的是( )
A.用醋酸去除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2
HCOOH+Cu2O↓+2H2O
C.实验室用液溴和苯在催化剂作用下制溴苯:
+Br2
+HBr
D.将CO2通入苯酚钠溶液:2
+CO2+H2O→2
+Na2CO3
难度: 中等查看答案及解析
-
化合物M(
)、N(
)、P(
)都是重要的有机物。下列有关M、N、P的说法正确的是( )
A.M与HBr发生加成反应的产物只有一种
B.P中所有碳原子一定共平面
C.M、N、P互为同分异构体
D.M能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
难度: 中等查看答案及解析
-
欲从苯酚的乙醇溶液中分离苯酚和乙醇,有下列操作:①蒸馏;②过滤;③静置分液;④加入足量的金属钠;⑤通入过量的二氧化碳;⑥加入足量的NaOH溶液;⑦加入足量的FeCl3溶液;⑧加入乙酸和浓硫酸的混合液加热。合理的实验操作步骤及顺序是( )
A.④⑤③ B.⑥①⑤③
C.⑧①⑦③ D.⑤②⑥③
难度: 简单查看答案及解析
-
某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )
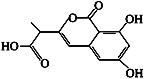
A.1 mol该有机物最多可以和5 mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不显色,但可使酸性KMnO4溶液褪色
D.1 mol该有机物与浓溴水反应,最多消耗3 mol Br2
难度: 中等查看答案及解析
-
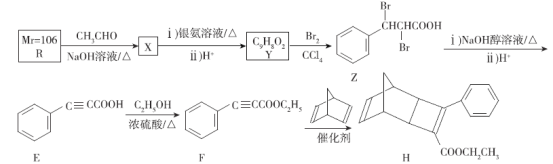
己烷雌酚的一种合成路线如下:
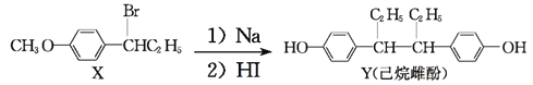
下列叙述不正确的是
A.在NaOH水溶液中加热,化合物X可发生消去反应
B.在一定条件下,1mol化合物Y可消耗4molBr2
C.用FeCl3溶液可鉴别化合物X和Y
D.化合物X与Y中手性碳原子数目比为1:2
难度: 中等查看答案及解析
-
一有机物A可发生如下变化,已知C为羧酸,而C、E都不能发生银镜反应,则A可能的结构有( )
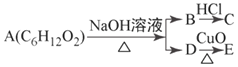
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol白磷(P4)和1mol甲烷中所含的共价键数均为4NA
B.标准状况下,22.4LCl2通入足量的NaOH溶液中,转移的电子数为NA
C.常温下,1L0.1mol·L-1NH4NO3溶液中所含的氢原子数为4NA
D.25℃时,0.5mol·L-1Na2S溶液中含有的阴离子数大于0.5NA
难度: 中等查看答案及解析
-
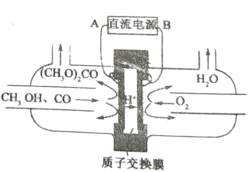
据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
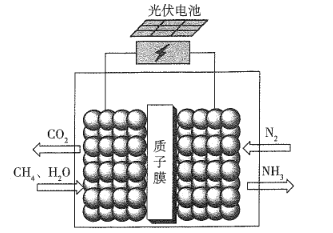
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
难度: 简单查看答案及解析
-
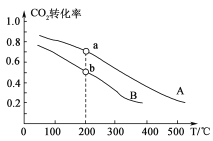
25℃时,向500 mL0.2 mol/L NaOH溶液中通入SO2气体(忽略反应过程中溶液的体积变化),设反应过程中
=x,已知H2SO3的电离平衡常数:Ka1=1.2×10-2,Ka2=5.6×10-8。下列说法正确的是( )
A. x=1时,c(SO32-)+c(HSO3-)=0.2 mol/L
B. x<1时,溶液可能为酸性
C. x=
时,c(SO32-)+c(HSO3-)+c(OH-)=c(Na+)+c(H+)
D. x<
时,随通入SO2量增大,
逐渐减小
难度: 中等查看答案及解析