-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH<0。
(1)在25℃、101 kPa下,1 g甲醇(液态)完全燃烧后,恢复到原状态放热Q kJ,则表示甲醇燃烧热的热化学方程式为 。
(2)工业上利用甲醇制备氢气常用的方法之一是甲醇蒸气重整法。此方法当中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),说明该反应能自发进行的原因 。
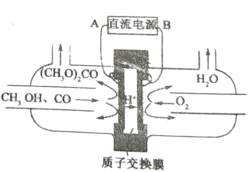
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。
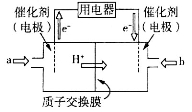
①通入气体a的电极是电池的______________(填“正”或“负”)极,其电极反应式为_______________;
②当电池中有2 mol e-发生转移时,左右两侧溶液的质量之差为__________________(忽略气体的溶解,假设反应物完全耗尽)。
-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g) ⇌ CH3OH(g) △H=-90.8 kJ·mol-1
(1)已知:2H2(g)+O2(g)=2H2O △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) △H=-241.8 kJ·mol-1
则CH3OH(g)+O2(g)=CO(g)+2H2O(g)的反应热△H= kJ·mol-1。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应:CH4(g)+ H2O(g)=CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如图。
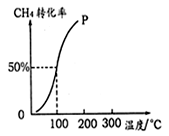
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应的平衡常数为 。
(3)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
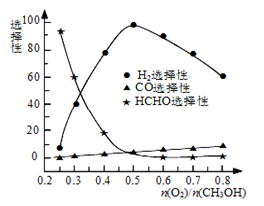
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ;在制备H2时最好控制n(O2)/n(CH3OH)= 。
-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)= CH3OH(l)△H=-37.3 kJ/mol,则CO2(g)+3H2(g) CH3OH(g)+H2O(l)△H=_______kJ/mol。
CH3OH(g)+H2O(l)△H=_______kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0 L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 M Pa和5.0 MPa下CO2转化率随温度的变化关系。
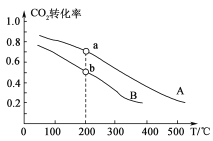
①其中a点的平衡常数表达式为:_________________。
②a,b两点化学反应速率分别用va、vb表示,则va________vb (填“大于”、“小于”或“等于”)。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。

A. 该反应的正反应为放热反应
B. 压强大小关系为p1<p2<p3
C. M点对应的平衡常数K的值约为1.04×10-2
D. 在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用 生产甲醇
生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H ______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_________K2(填“>”“<”或“=”)。
Ⅲ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为___________。
-
甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g)  CH3OH(g);ΔH=-90.8kJ/mol。
CH3OH(g);ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=____,如升高温度,K值将______(填:增大、减小或不变)。
(2)以下各项能说明该反应达到平衡状态的是____________.
A.混合气体的密度保持不变 B.甲醇的质量分数保持不变
C.CO的浓度保持不变 D.2v逆(H2)=v正(CH3OH)
(3)在210°C、240°C和270°C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
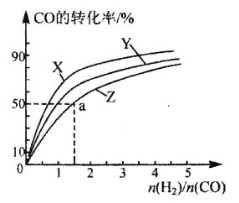
如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_____。由起始达到a点所需时间为5min,则H2的反应速率为:_______________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
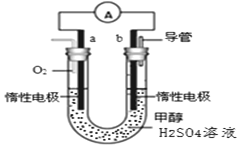
①该电池工作时,正极是____________极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
-
甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)==2H2O(l) ΔH=-571.6 kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为_______________。
(2)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s) 5CO2(g) +I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间t变化曲线如图所示。则:
5CO2(g) +I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间t变化曲线如图所示。则:
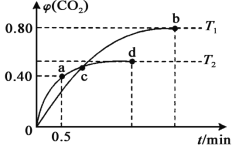
①T2温度时,0~0.5 min的反应速率v(CO)=___________。
②T1温度时,反应达到平衡,CO的转化率为_______,化学平衡常数K=_______(用具体数值表示)。
③下列说法正确的是_________(填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s) 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
-
按要求回答下列问题:
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)⇌CH3OH(g);△H1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是______(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0,T℃时,将2mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为______。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______。
-
(12分)甲醇是重要的燃料,有广阔的应用前景,工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)△H1=-116KJ·mol-1
CH3OH(g)△H1=-116KJ·mol-1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度 c.增大体系压强 d.使用高效催化剂
(2)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:
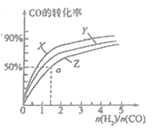
①在图中三条曲线,对应的温度由高到低的顺序是 。
②利用a点对用的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数,K= 。
CO(g)+2H2(g)的平衡常数,K= 。
(3)恒温下,分别将1molCO和2molH2置于恒容容器Ⅰ和恒压容器Ⅱ中(两容器起始溶剂相同),充分反应。
①达到平衡所需时间是Ⅰ Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中CH3OH的体积分数关系是Ⅰ Ⅱ。
②平衡时,测得容器Ⅰ中的压强减小了30%,则该容器中CO的转化率为 。
-
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=﹣116kJ•mol﹣1
CH3OH(g) △H1=﹣116kJ•mol﹣1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
H2(g)+ O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为________________________。
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
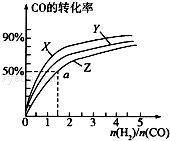
①在图中三条曲线,对应的温度由高到低的顺序是_________________。
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数:K=_______________。
CO(g)+2H2(g)的平衡常数:K=_______________。
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I_________Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I________Ⅱ。
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为_______。
-
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(ⅰ)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 
(ⅱ)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
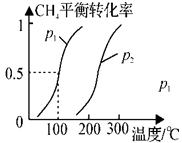
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
100℃时该反应的平衡常数K= ;若升高温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol
CO(g)和2mol H2(g),发生反应(ⅱ)。
①反应(ⅱ)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因是_________________(用化学方程式表示)。
-
(12分)甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为: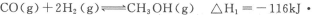

(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是_____。
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
(2)已知: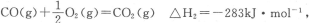
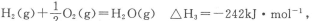
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________________.
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:
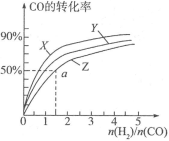
①在图中三条曲线,对应的温度由高到低的顺序是__________________;
②利用a点对应的数据,计算出曲线Z在对应温度下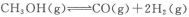 的平衡常数:K=______;
的平衡常数:K=______;
(4)恒温下,分别将1 molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应。
①达到平衡所需时间是I _____Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中CH3OH的体积分数关系是I_____Ⅱ。
②平衡时,测得容器工中的压强减小了30%,则该容器中CO的转化率为______。
CH3OH(g)+H2O(l)△H=_______kJ/mol。

CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。

生产甲醇
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。











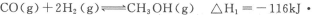
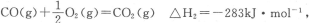
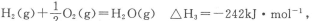

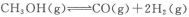 的平衡常数:K=______;
的平衡常数:K=______;